
De toegevoegde waarde van spierechografie bij patiënten met COPD: een verkennende studie
26 februari 2020Origineel artikel: Willemke Nijholt et al., The added value of ultrasound muscle measurements in patients with COPD: An exploratory study, Clinical Nutrition ESPEN 30 (2019) 152-158 (gebruiken als referentie bij verwijzing naar dit artikel)
Willemke Nijholt¹ ² *, Lies ter Beek¹ ³, Johannes S.M. Hobbelen¹ ⁴, Hester van der Vaart³, Johan B. Wempe³, Cees P. van der Schans ¹ ² ⁵, Harriët Jager-Wittenaar ¹ ⁶
¹ Hanze University of Applied Sciences, Research Group Healthy Ageing, Allied Health Care and Nursing, Groningen, the Netherlands
² University of Groningen, University Medical Center Groningen, Department of Rehabilitation Medicine, Groningen, the Netherlands
³ University of Groningen, University Medical Center Groningen, Department of Pulmonary Diseases and Tuberculosis, Center for Rehabilitation, Haren, Groningen, the Netherlands
⁴ University of Groningen, University Medical Center Groningen, Department of General Practice and Elderly Care Medicine, Groningen, the Netherlands
⁵ University of Groningen, University Medical Center Groningen, Health Psychology Research, Groningen, the Netherlands
⁶ University of Groningen, University Medical Center Groningen, Department of Maxillofacial Surgery, Groningen, the Netherlands
* Auteur met wie gecorrespondeerd kan worden: w.nijholt@pl.hanze.nl
Samenvatting
Achtergrond en doelstellingen: Ondervoeding en sarcopenie zijn veel voorkomende voeding(-gerelateerde) aandoeningen bij patiënten met COPD en worden geassocieerd met negatieve gezondheidsuitkomsten en mortaliteit. Deze studie heeft als doel spieromvang gemeten middels echografie te vergelijken met vetvrije massa en spierfunctie bij patiënten met COPD.
Methoden: Patiënten met COPD werden aan het begin van een longrevalidatieprogramma gevraagd deel te nemen aan deze studie. De rectus femoris (RF) omvang (dikte in cm, spieroppervlakte in cm2) werd gemeten met echografie. De vetvrije massa-index (VVMI) werd bepaald met behulp van bio-elektrische impedantie analyse. Handknijpkracht (HKK) werd gemeten in kilogram en de ‘five times sit-to-stand-test’ (in seconden, hogere scores duidden op een lage spierkracht) werd gebruikt om de spierkracht van de benen te bepalen. De Incremental Shuttle Walk Test (ISWT, in meters) werd gebruikt om de maximale inspanningscapaciteit te meten.
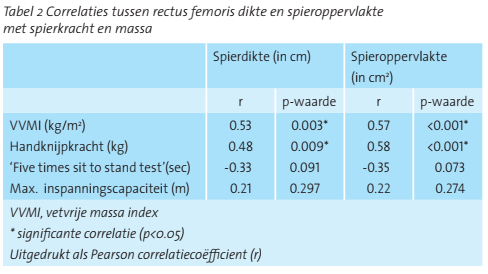
Resultaten: 44 patiënten met COPD (gemiddelde leeftijd 60,2 ± 9 jaar, waarvan 19 man (43%), werden geïncludeerd. Grotere RF-oppervlakte en RF-dikte waren geassocieerd met een hogere VVMI (oppervlakte: r = 0,57, p < 0,001; dikte: r = 0,53, p = 0,003) en HKK (oppervlakte: r = 0,58, p < 0,001, dikte r = 0,48, p = 0,009). RF omvang was niet gecorreleerd met beenspierkracht (oppervlakte: r = -0,35, p = 0,073; dikte: r = -0,33, p = 0,091). Verder bleek RF omvang niet gecorreleerd te zijn met maximale inspanningscapaciteit (oppervlakte: r = 0,22, p = 0,274; dikte: r = 0,21, p = 0,297).
Conclusie: Deze verkennende studie bij patiënten met COPD suggereert dat spieromvang matig gecorreleerd is met VVMI en HKK. Toekomstige studies moeten zich richten op de rol van spierechografie bij het diagnosticeren van sarcopenie en ondervoeding.
1. Inleiding
Chronisch obstructieve longziekten (COPD) is een complex ziektebeeld, waarbij meer speelt dan alleen vernauwde luchtwegen (Barnes, 2009; Donaldson, 2012; Maddocks, 2016). De ziektelast van COPD wordt voornamelijk bepaald door extrapulmonale beperkingen, zoals verminderde spierfunctie. Verlies van spiermassa en verminderde spierfunctie zijn belangrijke kenmerken van zowel ondervoeding als sarcopenie (Cruz-Jentoft, 2010; Cederholm, 2017). Deze twee aan voeding gerelateerde aandoeningen komen veel voor bij patiënten met COPD. De prevalentie van ondervoeding wordt geschat tussen de 11% en 62% (Ng, 2013; Luo, 2016; de Blasio, 2018; Ingadottir, 2018) en tussen de 9 en 35% voor wat betreft sarcopenie (Jones, 2015; van de Bool, 2015; Maddocks, 2016; de Blasio, 2018). Omdat met name het verlies van spiermassa in de benen geassocieerd is met slechter fysiek functioneren (Maltais, 2014; Takahashi, 2017) is beoordeling van de spiermassa in de benen bij deze patiënten van belang.
Methoden die gebruikt worden voor de beoordeling van spiermassa in de benen zijn bijvoorbeeld dual energy X-ray absorpiometry (DEXA) en segmentale bio-elektrische impedantie analyse (BIA). DEXA is een valide en betrouwbare methode, maar de hoge kosten en beperkte toegang tot de apparatuur beperken de klinische toepassing ervan (Buckinx, 2018). BIA is daarentegen een betrouwbare methode maar de validiteit is beperkt en afhankelijk van de gebruikte formules (Buchholz, 2004; Kyle, 2004). Echografie zou een valide en betrouwbaar alternatief kunnen zijn voor het kwantificeren van de skeletspieren (Arts, 2010; Nijholt, 2017). Er is echter weinig bekend over de relatie tussen de omvang van de skeletspieren en de totale spiermassa. Dit geldt ook voor de spierfunctie. Enkele onderzoeken bij patiënten met COPD laten een matige correlatie zien tussen de spieromvang van de rectus femoris (RED: rechte dijbeenspier) en de (RED: totale) vetvrije massa (Seymour, 2009; Shrikrishna, 2012), en tussen de spierfunctie, bijv. quadriceps sterkte (Seymour, 2009; Shrikrishna, 2012; Cruz-Montecinos, 2016; Rozenberg, 2017) en fysieke prestaties (Cruz-Montecinos, 2016; Rozenberg, 2017). Echter, de methoden die in deze studies zijn gebruikt om de spierfunctie te bepalen, worden in de klinische praktijk niet gebruikt. In de klinische praktijk wordt vaker gebruik gemaakt van de handknijpkracht, de ‘five times sit-to-stand test’ en de ‘incremental shuttle walk test’ (ISWT) (RED: dit is een uithoudingsvermogen test voor de beoordeling van de spierfunctie) (Eaton, 2006; Brouillard, 2008). Voor zover bekend, zijn er geen studies bekend die zich gericht hebben op de relatie tussen deze in de dagelijkse praktijk gebruikte methoden voor het beoordelen van de spierfunctie en de echografisch gemeten spieromvang. Daarom was het doel van deze studie om bij patiënten met COPD de relatie tussen echografisch gemeten spieromvang, vetvrije massa en spierfunctie te bestuderen.
2. Methoden
2.1. Studieopzet
Deze studie was onderdeel van een grotere observationele studie naar ziektegerelateerde ondervoeding en kwetsbaarheid bij patiënten met COPD. Gegevens voor deze studie zijn tussen maart 2015 en januari 2017 verzameld. Het studieprotocol is goedgekeurd door de Medisch Ethische Commissie van de Universitair Medisch Centrum Groningen (referentie 2014/432) en geregistreerd in het Nederlandse Trial register (NTR5107).
2.2. Onderzoeksgroep
Volwassen patiënten met COPD die startten met een negen weken durend longrevalidatieprogramma in het Universitair Medisch Centrum Groningen, Centrum voor Revalidatie, werden benaderd voor deelname. Deelnemers konden worden geïncludeerd als ze 40 jaar en ouder waren, de Nederlandse taal begrepen en spraken, gediagnosticeerd waren met COPD door een longarts en niet rolstoelgebonden waren. Deelnemers met een pacemaker, die een palliatieve behandeling ondergingen, huidproblemen hadden, een contra-indicatie hadden voor fysieke activiteit of ernstige cognitieve beperkingen hadden, werden uitgesloten van deelname aan de studie.
2.3 Metingen
2.3.1. Spierechografie
Echografische metingen werden uitgevoerd door twee diëtisten en een diëtist in opleiding die getraind waren in het uitvoeren van echografische spiermetingen. Voor de transversale afbeeldingen van de rectus femoris werd een draagbaar B-mode (RED: brightness mode) echoapparaat (Philips, VISQ) met een 5 MHZ ‘curved array transducer’ gebruikt (RED: een methode voor tweedimensionale echografische afbeeldingen; ‘curved array’ zegt iets over de eigenschappen van de echokop, ter onderscheiding van een ‘lineaire transducer’). Alle metingen werden in liggende positie op het rechterbeen uitgevoerd. Tijdens de metingen werden de deelnemers gevraagd om hun beenspieren te ontspannen. Metingen werden verricht halverwege de epicondylus lateralis en de trochanter major van het femur. Er werd een minimale druk op de echokop gezet om compressie van de spier te voorkomen. De metingen werden achteraf verricht op de echografische beelden en werden door twee onafhankelijke echoscopisten geanalyseerd. De omvang van de rectus femoris werd op twee manieren beoordeeld: de spierdikte (in cm) en het oppervlakte (in cm2). De dikte van de rectus femoris werd gedefinieerd als de afstand tussen de oppervlakkige en diepe aponeurose. Voor de meting van de spieroppervlakte werden de spierfacies beiderzijds geïdentificeerd waartussen een ellipsvormige regio werd geselecteerd om te meten. Het gemiddelde van drie opeenvolgende metingen van de dikte en oppervlakte van de rectus femoris werden genoteerd.
2.3.2. Vetvrije massa
De vetvrije massa (VVM) werd met behulp van multi-frequentie bio-elektrische impedantie analyse (BIA, Quadscan 4000, Bodystat) bepaald (Kyle, 2004). De vetvrije massa werd berekend met de ziektespecifieke Rutten formule (Rutten, 2010):
- VVM (kg) = – 11.81 + (0.245 x gewicht in kg) + (0.298 x lengte in meters2/impedantie) + (0.148 x lengte in meters) + (5.248 x geslacht, 1 voor mannen, 0 voor vrouwen)
- Vetvrije massa index (VVMI) (kg/m2) = totale vetvrije massa/lengte in meters2.
2.3.3.Spierfunctie
2.3.3.1. Handknijpkracht
De handknijpkracht werd gemeten met een handdynamometer van het merk JAMAR. Metingen werden aan beide zijden drie keer uitgevoerd. De beste prestatie van de rechter- of linkerzijde werd genomen om de maximale handknijpkracht in kilo’s te definiëren (Bohannon, 2003).
2.3.3.2. Beenspierkracht
De ‘five times sit-to-stand test’ werd gebruikt om de spierkracht van de benen te bepalen (Csuka, 1985). Deelnemers werd gevraagd om zo snel mogelijk vijf keer op te staan van een in hoogte verstelbare stoel zonder armleuningen, zonder de armen daarbij te gebruiken. Tijdens de test werd de deelnemers gevraagd om hun armen over hun borst over elkaar te vouwen. De test was voltooid na de laatste stand-up van de deelnemers. Beenspierkracht werd gemeten als de benodigde tijd om op te staan uit de stoel en werd uitgedrukt in seconden, waarbij hogere scores duidden op een lage beenspierkracht.
2.3.3.3. Maximale inspanningscapaciteit.
Om de maximale inspanningscapaciteit te meten werd de Incremental Shuttle Walk Test (ISWT) gebruikt (Revill, 1999). Deelnemers moesten een 10 m lang parcours zo lang mogelijk lopen. De loopsnelheid werd geleidelijk verhoogd en extern geregeld met akoestische signalen. De deelnemer moest het einde van het parcours vóór het audiosignaal bereiken. De test werd beëindigd als dit niet lukte of als de deelnemer aangaf te zijn uitgeput. De maximale inspanningscapaciteit werd uitgedrukt in meters.
2.4. Statistische analyse
De Shapiro Wilk-test werd gebruikt om te beoordelen of de data normaal verdeeld waren. Categorische variabelen werden uitgedrukt in relatieve frequenties en continue variabelen werden weergegeven in gemiddelde ± SD of mediaan met interkwartiel range (IQR) voor niet-normaal verdeelde variabelen. Correlaties werden getest met behulp van de Pearson-coëfficiënten (normaal verdeelde data) of Spearmans rho (niet-normaal verdeelde data). De interbeoordelaars betrouwbaarheid voor het analyseren van de echosopische beelden, werd bepaald met behulp van intraclass correlatie coëfficiënten (ICC) en Bland-Altmans plots. Beoordelaar 1 had meer dan vier jaar en beoordelaar 2 één jaar ervaring in spierechografie. Een goede overeenkomst tussen de beoordelaars werd gedefinieerd als een ICC-score van ≥ 0,81 (Mota, 2012). Wanneer er sprake was van een goede overeenkomst, werden de metingen van beoordelaar 1 voor verdere analyse gebruikt. Alle statistische analyses werden uitgevoerd met behulp van SPSS (versie 23.0 (SPPS inc., Chicago, IL, VS). Een p-waarde van <0,05 werd als statistisch significant beschouwd.
3. Resultaten
Bij 44 van de in totaal 84 patiënten met COPD die toestemden om mee te doen aan de (RED: in Studieopzet beschreven) grotere observationele studie en voldeden aan de inclusiecriteria, werd spierechografie verricht (tabel 1). De gemiddelde leeftijd van de onderzoeksgroep was 60,2 ± 9 jaar, waarvan 19 (43%) man was. De mediane FEV1 (RED: de hoeveelheid lucht die de eerste seconde zo snel en zo hard mogelijk kan worden uitgeblazen) was 0,96 L (IQR = 0,80-1,49). Geen enkele deelnemer werd geclassificeerd als stadium GOLD I, 34 % als GOLD II, 34% als GOLD III en 32% als GOLD IV.
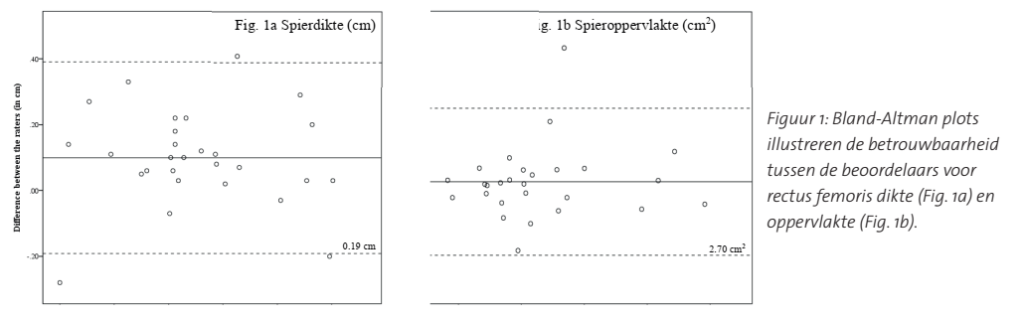
De overeenkomst tussen beide beoordelaars van de echografische beelden was goed voor zowel de gemeten dikte (ICC = 0,94, 95% CI: 0,91-0,94) als oppervlakte (ICC = 0,87, 95% CI0,73-0,94) van de rectus femoris. De Bland-Altman analyses toonden een kleine systematische fout van 0,11 cm voor de spierdikte en 0,09 cm2 voor de spieroppervlakte meting (figuur 1).
Van de 44 patiënten van wie beelden beschikbaar waren, konden er 30 (68%) worden geanalyseerd. Veertien echografiebeelden konden niet worden beoordeeld omdat de grenzen van de rectus femoris onvoldoende zichtbaar waren. Er waren geen significante verschillen in leeftijd (p=0,787), BMI (p=0,812), VVMI (p=0,885), triceps huidplooidikte (p=0,903) en ernst van de COPD (0,693) tussen de patiënten waarvan de beelden wel of niet konden worden beoordeeld.
3.1 Spieromvang in relatie tot de VVM en spierfunctie
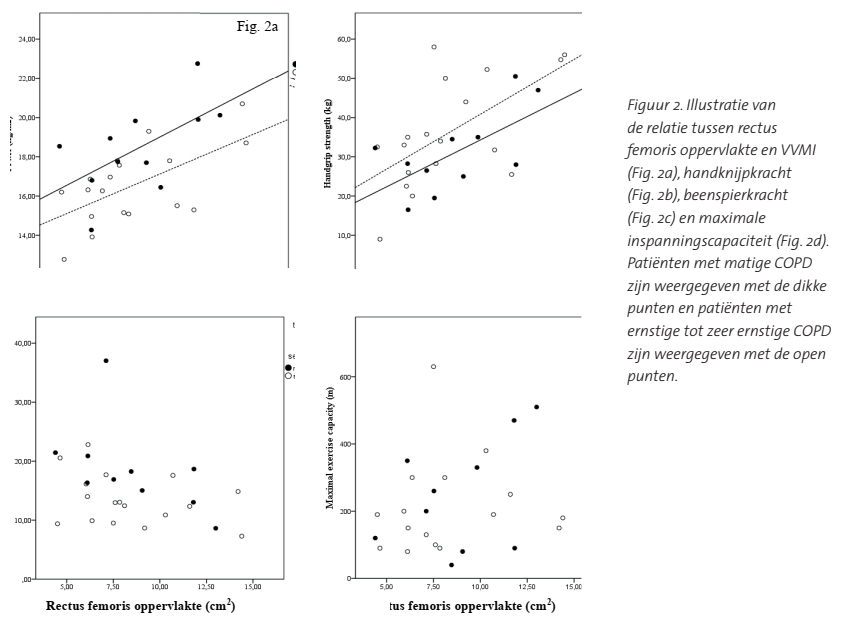
De gemiddelde spierdikte was 1,81 ± 0,40 cm voor mannen en 1,58 ± 0.28 cm voor vrouwen (p = 0,086) (Tabel 1). Patiënten met (zeer) ernstige COPD hadden een vergelijkbare rectus femoris oppervlakte (8,15 ± 2,89 cm2) en dikte (1,66 ± 0,36 cm) als patiënten met matige COPD (oppervlakte: 8,66 ± 2,74 cm2; dikte: 1,72 ± 0,35 cm) (p=0,65 en p=0,68). Een hogere VVMI was geassocieerd met een grotere spieroppervlakte (r=0,57, p<0,001) en dikte (r=0,53, p=0,003) van de rectus femoris. De correlatie verschilde niet tussen mannen en vrouwen (Figuren 2 en 3). Bij patiënten met matige COPD was de correlatie tussen de dikte van de rectus femoris en de VVMI (r=0,70, p=0,015) sterker dan bij patiënten met (zeer) ernstige COPD (r=0,40, p=0,087). Tevens waren de rectus femoris oppervlakte (r=0,58, p<0,001) en dikte (r=0,48, p=0,009) gecorreleerd met de handknijpkracht. De rectus femoris oppervlakte (r=-0.35, p=0,073) en dikte (r=-0,33, p=0,091) waren niet significant gecorreleerd met beenspierkracht. Er werd geen correlatie waargenomen tussen de rectus femoris spieromvang en de maximale inspanningscapaciteit (dikte: r=0,21, p= 0,297; oppervlakte: r=0,22, p=0,274) (tabel 2). Net als bij de spieromvang, werd ook een correlatie tussen de HKK en de VVMI waargenomen (r=0,50, p=0,007). Er waren geen correlaties tussen beenspierkracht (r=-0,10, p=0,616),maximale inspanningscapaciteit (r=0,23, p=0,265) en VVMI.
4. Discussie
Deze studie bij patiënten met COPD suggereert dat de omvang van de rectus femoris, d.w.z. dikte en oppervlakte, gecorreleerd is met de vetvrije massa en de handknijpkracht. Er werd geen significante correlatie gevonden tussen de omvang van de rectus femoris en de beenspierkracht, waarschijnlijk door onvoldoende ‘power’ van de studie (RED: als gevolg van een te kleine onderzoeksgroep).
In deze studie werd spieromvang op twee manieren gemeten: spieroppervlakte en spierdikte. Deze studie laat zien dat de relatie tussen beide parameters voor spieromvang en VVMI en functie niet verschillend is. Verder vonden we geen systematische verschillen in de betrouwbaarheid van beide parameters. Hierdoor lijken zowel de spieroppervlakte als de spierdikte meting bruikbaar. Het voordeel van het beoordelen van de oppervlakte van de rectus femoris is dat deze representatief is voor de omvang van de gehele spier. Bij grotere spieren kan de oppervlakte mogelijk niet volledig worden bepaald vanwege het beperkte bereik van de transducer. Bovendien kunnen de grenzen van de spier moeilijk te visualiseren zijn in een klinische populatie (Seymour, 2009). Spierdikte kan daarentegen eenvoudiger worden bepaald en is daarom mogelijk een geschikte meting voor de dagelijkse praktijk.
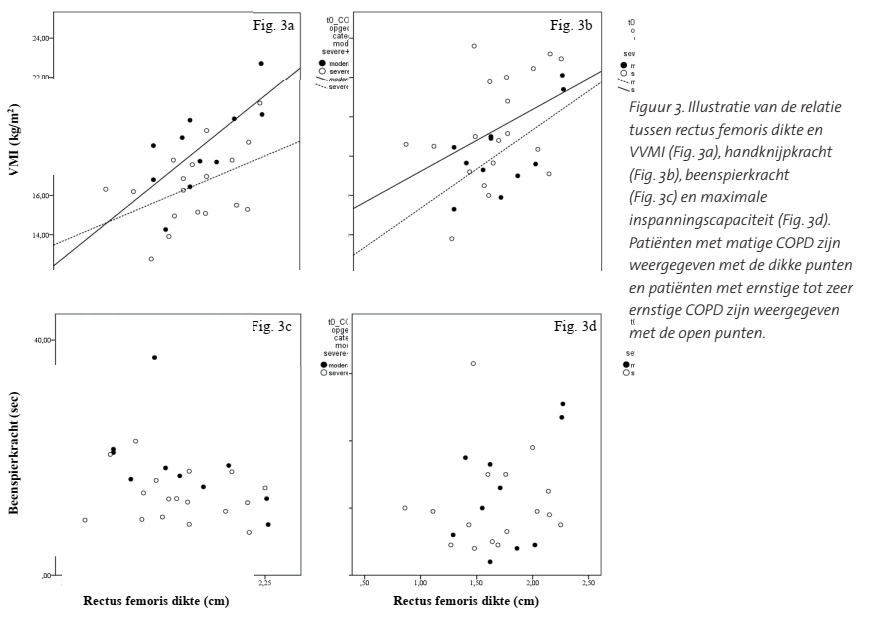
We zagen dat zowel de rectus femoris dikte als oppervlakte matig gecorreleerd zijn met de VVMI. Deze bevindingen komen overeen met eerdere studies bij patiënten met COPD, die ook lieten zien dat de oppervlakte van de rectus femoris geassocieerd was met de VVMI (Seymour, 2009; Shrikrishna, 2012).
Een opvallend resultaat van deze studie is dat de correlatie tussen de dikte van de rectus femoris en VVMI minder sterk was bij patiënten met (zeer) ernstige COPD dan bij patiënten met matige COPD (r=0,70 vs. r=0,4). Dit zou kunnen worden verklaard door het feit dat bij patiënten met (zeer) ernstige COPD met name de spiermassa in de benen afneemt (Seymour, 2009; Shrikrishna, 2012). Patiënten met (zeer) ernstige COPD bleken gemiddeld echter geen significant kleinere (RED: been-)spierdikte te hebben, wat in overeenstemming is met een eerdere studie (Seymour, 2009). Een andere verklaring zou kunnen zijn dat bij patiënten met (zeer) ernstige COPD de spieromvang gelijk blijft, maar dat de hoeveelheid intramusculair vet toeneemt, waardoor de spierfunctie vermindert (Robles, 2015). Tot slot zou dit resultaat verklaard kunnen worden door een overschatting van de VVMI bij patiënten met (zeer) ernstige COPD, als gevolg van oedeem (Wouters, 2004).
In deze studie vonden we een redelijke correlatie tussen spieromvang en handknijpkracht, wat suggereert dat lokale spieromvang ook gerelateerd zou kunnen zijn aan de algehele kracht. Behalve als indicator van de algehele kracht (Rantanen, 1994), is de handknijpkracht een goede voorspeller voor invaliditeit en mortaliteit (Rantanen, 1999; Janssen, 2000; Norman, 2011; Celis-Morales, 2018). Hoewel de handknijpkracht ook wordt beïnvloed door niet-nutritionele factoren zoals inflammatie (Norman, 2014), wordt de handknijpkracht in de klinische praktijk vaak gebruikt als maat voor de voedingsstatus (Norman, 2011). Vervolgonderzoek moet uitwijzen wat de rol van spierechografie kan zijn bij het diagnosticeren van ondervoeding en sarcopenie.
Overeenkomstig bevindingen uit een eerdere studie (Cruz-Montecinos, 2016), was in onze studie de omvang van de rectus femoris niet gerelateerd aan beenspierkracht en inspanningscapaciteit. Een mogelijke verklaring hiervoor is dat inspanningscapaciteit door vele andere factoren, zowel binnen als buiten de long, wordt bepaald (Jobin, 1998). De omvang van de rectus femoris en andere parameters van spiermassa en functie, kunnen voorspellend zijn voor de inspanningscapaciteit, maar dat kunnen we niet concluderen uit deze verkennende studie. De afwezigheid van een correlatie tussen spieromvang en kracht zou verklaard kunnen worden door de kleine onderzoeksgroep wat mogelijk heeft geleid tot een type II fout, omdat de gevonden p-waarden bijna significant waren. Vervolgonderzoek is nodig om de relatie tussen (het verlies van) spieromvang en maximale inspanningscapaciteit te onderzoeken.
Een onverwachtse bevinding van deze studie was dat de echografiebeelden niet altijd interpreteerbaar zijn. Hoewel deze studie suggereert dat echografie een betrouwbaar middel is voor het bepalen van de spieromvang, merkten wij ook dat de interpretatie ervan lastig kan zijn bij patiënten met (zeer) ernstige COPD. Bij 14 van de 44 echografie beelden konden zowel de oppervlakte als de dikte van de rectus femoris niet worden bepaald omdat de randen van de rectus femoris niet konden worden gedefinieerd. Er zijn twee mogelijke verklaringen voor de niet-interpreteerbare echografie afbeeldingen. Enerzijds zou het kunnen zijn dat de anatomie beïnvloed is door oedeem en door onderhuids vet (Seymour, 2009; Cruz-Montecinos, 2016). Anderzijds kan een verhoogde echogeniciteit, d.w.z. een helderdere weergave van de spier door de reflectie van intramusculair vet (Pillen, 2009), leiden tot niet-interpreteerbare afbeeldingen voor de spieromvang. In onze studie vonden we geen significante verschillen betreffende gezondheidsgerelateerde variabelen tussen patiënten met en zonder interpreteerbare echografie afbeeldingen. In toekomstig onderzoek bij patiënten met (ernstige) COPD, moet daarom rekening worden gehouden met onderhuids vetweefsel, oedeem en vet in de spier als spieren echografisch beoordeeld worden.
In deze studie relateren we spieromvang gemeten met echografie aan dagelijks gebruikte methoden voor de beoordeling van spiermassa en -functie bij patiënten met COPD. Onze studie laat zien dat perifere spieromvang geassocieerd is met de totale vetvrije massa in het lichaam. Desalniettemin is het van groot belang alle perifere spieren te evalueren, omdat het verlies aan spiermassa niet bij alle spieren even groot zal zijn (Janssen, 2000), en omdat ondervoeding vooral de armspieren beïnvloedt, terwijl chronische inactiviteit meer wordt geassocieerd met verlies van spiermassa in de benen (Heymsfield, 1994).
Oppervlakkige spieren kunnen makkelijk worden bekeken met echografie, maar training in het gebruik en de interpretatie van de beelden is nodig voordat zorgprofessionals echografie kunnen toepassen bij het meten van spieren.
Naast de kleine onderzoeksgroep en de transversale onderzoeksopzet, moet voor de interpretatie van onze resultaten rekening gehouden worden met een aantal andere beperkingen van het onderzoek. Allereerst werd voor het inschatten van de VVMI de BIA gebruikt, wat niet de gouden standaard is voor de beoordeling van de spiermassa en mogelijk tot een over- of onderschatting van de VVMI heeft geleid, bijvoorbeeld vanwege een veranderde hydratiestatus (Kyle, 2004). Desalniettemin wordt de BIA vaak gebruikt in de klinische praktijk en daarom is het interessant om het verband tussen de omvang van de perifere spieren verkregen met echografie en de VVM gemeten met BIA te bepalen.
Ten tweede werd een echoapparaat gebruikt dat is ontwikkeld voor abdominale scans. Ofschoon we het standaard buikprotocol optimaliseerden voor de beoordeling van spieren, gebruikten we de ingebouwde software voor het bepalen van spieroppervlakte die gebruikmaakt van een ellipsvorm. Dit zou tot een overschatting van de werkelijke oppervlakte van de rectus femoris kunnen hebben geleid, omdat de spier geen perfecte ellips is. Voorts kon met dit type echoapparaat geen echogeniciteit van de spier worden bepaald en daarom konden we niet beoordelen of (toegenomen) echogeniciteit van de spier geassocieerd is met de vetvrije massa en de spierfunctie van deze groep patiënten met COPD.
Ten derde gebruikten we voor deze studie een ‘curved-array transducer’ bij de beoordeling van de spieren. Een nadeel van dit type transducer dat een groot oppervlak kan meten, is de beperktere resolutie. Dit kan ook resulteren in onjuiste interpretatie van de echografische beelden. Niettemin toonde een eerdere studie aan dat de ‘curved-array transducer’ valide en betrouwbaar is voor de beoordeling van spieren in vergelijking tot de ‘lineaire transducer’ (Hammond, 2014). Tenslotte werden de metingen door verschillende onderzoekers gedaan, hetgeen tot bias kan hebben geleid.
Concluderend laat dit onderzoek zien dat echografisch gemeten spieromvang samenhangt met de VVMI en kracht bij patiënten met COPD. Ernst van de ziekte zou de relatie tussen spieromvang en VVMI kunnen beïnvloeden. Echografische beoordeling van perifere spieren kan een belangrijke rol spelen in de klinische praktijk, waarbij in overweging moet worden genomen dat de echogeniciteit verhoogd kan zijn bij patiënten met COPD.
De auteurs rapporteren geen belangenverstrengeling. Het project werd niet gesponsord. De auteurs bedanken de deelnemers aan de studie en Margot Broeze voor haar hulp bij de analyse van de echografische beelden.
Vertaald door Monique van Kemenade en Gerdien Ligthart-Melis.
Referenties
Arts, I. M., S. Pillen, H. J. Schelhaas, S. Overeem and M. J. Zwarts (2010). “Normal values for quantitative muscle ultrasonography in adults.” Muscle & Nerve: Official Journal of the American Association of Electrodiagnostic Medicine 41(1): 32-41.
Barnes, P. and B. Celli (2009). “Systemic manifestations and comorbidities of COPD.” European respiratory journal 33(5): 1165-1185.
Bohannon, R. W. (2003). “Grip strength: a summary of studies comparing dominant and nondominant limb measurements.” Perceptual and motor skills 96(3): 728-730.
Brouillard, C., V. Pepin, J. Milot, Y. Lacasse and F. Maltais (2008). “Endurance shuttle walking test: responsiveness to salmeterol in COPD.” European respiratory journal 31(3): 579-584.
Buchholz, A. C., C. Bartok and D. A. Schoeller (2004). “The validity of bioelectrical impedance models in clinical populations.” Nutrition in clinical practice 19(5): 433-446.
Buckinx, F., F. Landi, M. Cesari, R. A. Fielding, M. Visser, K. Engelke, S. Maggi, E. Dennison, N. M. Al-Daghri, S. Allepaerts, J. Bauer, I. Bautmans, M. L. Brandi, O. Bruyere, T. Cederholm, F. Cerreta, A. Cherubini, C. Cooper, A. Cruz-Jentoft, E. McCloskey, B. Dawson-Hughes, J. M. Kaufman, A. Laslop, J. Petermans, J. Y. Reginster, R. Rizzoli, S. Robinson, Y. Rolland, R. Rueda, B. Vellas and J. A. Kanis (2018). “Pitfalls in the measurement of muscle mass: a need for a reference standard.” J Cachexia Sarcopenia Muscle 9(2): 269-278.
Cederholm, T., R. Barazzoni, P. Austin, P. Ballmer, G. Biolo, S. C. Bischoff, C. Compher, I. Correia, T. Higashiguchi and M. Holst (2017). “ESPEN guidelines on definitions and terminology of clinical nutrition.” Clinical Nutrition 36(1): 49-64.
Celis-Morales, C. A., P. Welsh, D. M. Lyall, L. Steell, F. Petermann, J. Anderson, S. Iliodromiti, A. Sillars, N. Graham and D. F. Mackay (2018). “Associations of grip strength with cardiovascular, respiratory, and cancer outcomes and all cause mortality: prospective cohort study of half a million UK Biobank participants.” bmj 361: k1651.
Cruz-Jentoft, A. J., J. P. Baeyens, J. M. Bauer, Y. Boirie, T. Cederholm, F. Landi, F. C. Martin, J. P. Michel, Y. Rolland, S. M. Schneider, E. Topinkova, M. Vandewoude and M. Zamboni (2010). “Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People.” Age Ageing 39(4): 412-423.
Cruz-Montecinos, C., C. Guajardo-Rojas, E. Montt, F. Contreras-Briceño, R. Torres-Castro, O. Díaz and A. Cuesta-Vargas (2016). “Sonographic measurement of the quadriceps muscle in patients with chronic obstructive pulmonary disease: functional and clinical implications.” Journal of Ultrasound in Medicine 35(11): 2405-2412.
Csuka, M. and D. J. McCarty (1985). “Simple method for measurement of lower extremity muscle strength.” The American journal of medicine 78(1): 77-81.
de Blasio, F., A. Di Gregorio, F. de Blasio, A. Bianco, B. Bellofiore and L. Scalfi (2018). “Malnutrition and sarcopenia assessment in patients with chronic obstructive pulmonary disease according to international diagnostic criteria, and evaluation of raw BIA variables.” Respiratory medicine 134: 1-5.
Donaldson, A. V., M. Maddocks, D. Martolini, M. I. Polkey and W. D. Man (2012). “Muscle function in COPD: a complex interplay.” International journal of chronic obstructive pulmonary disease 7: 523-535.
Eaton, T., P. Young, K. Nicol and J. Kolbe (2006). “The endurance shuttle walking test: a responsive measure in pulmonary rehabilitation for COPD patients.” Chronic Respiratory Disease 3(1): 3-9.
Hammond, K., J. Mampilly, F. A. Laghi, A. Goyal, E. G. Collins, C. McBurney, A. Jubran and M. J. Tobin (2014). “Validity and reliability of rectus femoris ultrasound measurements: comparison of curved-array and linear-array transducers.” Journal of rehabilitation research and development 51(7): 1155.
Heymsfield, S. (1994). “Nutritional assessment by anthropometric and biochemical methods.” Modern nutrition in health and disease 1: 812-841.
Ingadottir, A. R., A. M. Beck, C. Baldwin, C. E. Weekes, O. G. Geirsdottir, A. Ramel, T. Gislason and I. Gunnarsdottir (2018). “Two components of the new ESPEN diagnostic criteria for malnutrition are independent predictors of lung function in hospitalized patients with chronic obstructive pulmonary disease (COPD).” Clinical Nutrition 37(4): 1323-1331.
Janssen, I., S. B. Heymsfield, R. N. Baumgartner and R. Ross (2000). “Estimation of skeletal muscle mass by bioelectrical impedance analysis.” Journal of applied physiology 89(2): 465-471.
Janssen, I., S. B. Heymsfield, Z. Wang and R. Ross (2000). “Skeletal muscle mass and distribution in 468 men and women aged 18–88 yr.” Journal of applied physiology 89(1): 81-88.
Jobin, J., F. Maltais, J.-F. Doyon, P. LeBlanc, P.-M. Simard, A.-A. Simard and C. Simard (1998). “Chronic obstructive pulmonary disease: capillarity and fiber-type characteristics of skeletal muscle.” Journal of Cardiopulmonary Rehabilitation and Prevention 18(6): 432-437.
Jones, S. E., M. Maddocks, S. S. Kon, J. L. Canavan, C. M. Nolan, A. L. Clark, M. I. Polkey and W. D. Man (2015). “Sarcopenia in COPD: prevalence, clinical correlates and response to pulmonary rehabilitation.” Thorax 70(3): 213-218.
Kyle, U. G., I. Bosaeus, A. D. De Lorenzo, P. Deurenberg, M. Elia, J. M. Gómez, B. L. Heitmann, L. Kent-Smith, J.-C. Melchior and M. Pirlich (2004). “Bioelectrical impedance analysis—part I: review of principles and methods.” Clinical nutrition 23(5): 1226-1243.
Kyle, U. G., I. Bosaeus, A. D. De Lorenzo, P. Deurenberg, M. Elia, G. J. Manuel, H. B. Lilienthal, L. Kent-Smith, J. C. Melchior, M. Pirlich, H. Scharfetter, W. J. Schols and C. Pichard (2004). “Bioelectrical impedance analysis-part II: utilization in clinical practice.” Clin.Nutr. 23(6): 1430-1453.
Luo, Y., L. Zhou, Y. Li, S. Guo, X. Li, J. Zheng, Z. Zhu, Y. Chen, Y. Huang and R. Chen (2016). “Fat-free mass index for evaluating the nutritional status and disease severity in COPD.” Respiratory care 61(5): 680-688.
Maddocks, M., S. S. Kon, J. L. Canavan, S. E. Jones, C. M. Nolan, A. Labey, M. I. Polkey and W. D. Man (2016). “Physical frailty and pulmonary rehabilitation in COPD: a prospective cohort study.” Thorax 71(11): 988-995.
Maltais, F., M. Decramer, R. Casaburi, E. Barreiro, Y. Burelle, R. Debigare, P. N. Dekhuijzen, F. Franssen, G. Gayan-Ramirez, J. Gea, H. R. Gosker, R. Gosselink, M. Hayot, S. N. Hussain, W. Janssens, M. I. Polkey, J. Roca, D. Saey, A. M. Schols, M. A. Spruit, M. Steiner, T. Taivassalo, T. Troosters, I. Vogiatzis, P. D. Wagner and A. E. A. H. C. o. L. M. D. i. COPD (2014). “An official American Thoracic Society/European Respiratory Society statement: update on limb muscle dysfunction in chronic obstructive pulmonary disease.” Am J Respir Crit Care Med 189(9): e15-62.
Mota, P., A. G. Pascoal, F. Sancho and K. Bø (2012). “Test-retest and intrarater reliability of 2-dimensional ultrasound measurements of distance between rectus abdominis in women.” journal of orthopaedic & sports physical therapy 42(11): 940-946.
Ng, M. G., S. S. Kon, J. L. Canavan, A. L. Clark, C. M. Nolan, S. E. Jones, M. I. Polkey, M. Elia and W. D.-C. Man (2013). Prevalence and effects of malnutrition in COPD patients referred for pulmonary rehabilitation, Eur Respiratory Soc.
Nijholt, W., A. Scafoglieri, H. Jager‐Wittenaar, J. S. Hobbelen and C. P. van der Schans (2017). “The reliability and validity of ultrasound to quantify muscles in older adults: a systematic review.” Journal of cachexia, sarcopenia and muscle 8(5): 702-712.
Norman, K., N. Stobäus, M. C. Gonzalez, J.-D. Schulzke and M. Pirlich (2011). “Hand grip strength: outcome predictor and marker of nutritional status.” Clinical nutrition 30(2): 135-142.
Norman, K., N. Stobäus, K. Kulka and J. Schulzke (2014). “Effect of inflammation on handgrip strength in the non-critically ill is independent from age, gender and body composition.” European journal of clinical nutrition 68(2): 155.
Pillen, S., R. O. Tak, M. J. Zwarts, M. M. Lammens, K. N. Verrijp, I. M. Arts, J. A. van der Laak, P. M. Hoogerbrugge, B. G. van Engelen and A. Verrips (2009). “Skeletal muscle ultrasound: correlation between fibrous tissue and echo intensity.” Ultrasound in medicine & biology 35(3): 443-446.
Rantanen, T., P. Era, M. Kauppinen and E. Heikkinen (1994). “Maximal isometric muscle strength and socioeconomic status, health, and physical activity in 75-year-old persons.” Journal of aging and physical activity 2(3): 206-220.
Rantanen, T., J. M. Guralnik, D. Foley, K. Masaki, S. Leveille, J. D. Curb and L. White (1999). “Midlife hand grip strength as a predictor of old age disability.” Jama 281(6): 558-560.
Revill, S., M. Morgan, S. Singh, J. Williams and A. Hardman (1999). “The endurance shuttle walk: a new field test for the assessment of endurance capacity in chronic obstructive pulmonary disease.” Thorax 54(3): 213-222.
Robles, P. G., M. S. Sussman, A. Naraghi, D. Brooks, R. S. Goldstein, L. M. White and S. Mathur (2015). “Intramuscular Fat Infiltration Contributes to Impaired Muscle Function in COPD.” Medicine and science in sports and exercise 47(7): 1334-1341.
Rozenberg, D., V. Martelli, L. Vieira, A. Orchanian-Cheff, N. Keshwani, L. G. Singer and S. Mathur (2017). “Utilization of non-invasive imaging tools for assessment of peripheral skeletal muscle size and composition in chronic lung disease: A systematic review.” Respiratory medicine 131: 125-134.
Rutten, E. P., M. A. Spruit and E. F. Wouters (2010). “Critical view on diagnosing muscle wasting by single-frequency bio-electrical impedance in COPD.” Respiratory medicine 104(1): 91-98.
Seymour, J. M., K. Ward, P. S. Sidhu, Z. Puthucheary, J. Steier, C. J. Jolley, G. Rafferty, M. I. Polkey and J. Moxham (2009). “Ultrasound measurement of rectus femoris cross-sectional area and the relationship with quadriceps strength in COPD.” Thorax 64(5): 418-423.
Shrikrishna, D., M. Patel, R. J. Tanner, J. M. Seymour, B. A. Connolly, Z. A. Puthucheary, S. L. Walsh, S. A. Bloch, P. S. Sidhu and N. Hart (2012). “Quadriceps wasting and physical inactivity in patients with COPD.” European Respiratory Journal 40(5): 1115-1122.
Takahashi, T., M. Sugie, M. Nara, T. Koyama, S. P. Obuchi, K. Harada, S. Kyo and H. Ito (2017). “Femoral muscle mass relates to physical frailty components in community‐dwelling older people.” Geriatrics & gerontology international 17(10): 1636-1641.
van de Bool, C., E. P. Rutten, F. M. Franssen, E. F. Wouters and A. M. Schols (2015). “Antagonistic implications of sarcopenia and abdominal obesity on physical performance in COPD.” Eur Respir J 46(2): 336-345.
Wouters, E. (2004). “Management of severe COPD.” The Lancet 364(9437): 883-895.




