Nutritional assessment en voedingsinterventies bij patiënten met chronisch en/of eindstadium nierfalen
1 oktober 2021Promotietraject bij patiënten met chronisch en/of eindstadium nierfalen als start van toekomstige onderzoekslijn Voeding en Nierziekten in het Erasmus Medisch centrum
Auteurs: Wesley J. Visser1, Anneke M.E. de Mik-van Egmond1.
1Department of Internal Medicine, Division of Dietetics, Erasmus MC, University Medical Center, 3015 GD Rotterdam, The Netherlands
Voeding & Visie 2021(34);27-33
Nutritional assessment and -interventions in patients with chronic or end-stage
Abstract
On average 40% of hemodialysis patients suffer from protein-energy wasting. This amounts to approximately 2000 patients on hemodialysis in The Netherlands who suffer from malnutrition. Malnutrition is a condition that manifests in the loss of muscle mass and thus leads to the loss of muscle strength, reduced self-sufficiency, increased mortality, more hospital admissions, and a lower quality of life. This means that an intervention that can prevent loss of muscle mass can also improve quality of life. Several possible nutritional interventions could contribute to the prevention and/or treatment of muscle mass loss. One possible intervention is intradialytic parenteral nutrition (IDPN). This is nutrition added to the bloodstream during dialysis. Previous research showed that IDPN can provide a positive protein balance. As a result, IDPN appears to be a promising treatment to prevent loss of muscle mass in hemodialysis patients. In addition to dietary interventions that increase protein intake, there are also potential dietary interventions that can reduce protein degradation and thus have a positive effect on protein balance. Given the importance of muscle mass in kidney failure and hemodialysis patients, it is essential to determine this correctly. The aim of the studies we will perform is to find effective nutritional interventions and in addition to determine the correct method for muscle mass determination in kidney failure and hemodialysis patients.
Samenvatting
Gemiddeld 40% van de hemodialysepatiënten lijdt aan ‘protein-energy wasting‘ zoals ondervoeding bij patiënten met nierfalen wordt genoemd. Dit komt neer op ca. 2000 patiënten per jaar in Nederland. Ondervoeding is een toestand die zich uit in het verlies van spiermassa en daarmee leidt tot het verlies van spierkracht, verminderde zelfredzaamheid, hogere mortaliteit, meer ziekenhuis opnames en een lagere kwaliteit van leven. De relatie tussen spiermassa en kwaliteit van leven betekent dat een interventie die verlies van spiermassa kan voorkomen, ook de kwaliteit van leven kan verbeteren. Er zijn meerdere voedingsinterventies die een bijdrage zouden kunnen leveren aan het voorkomen en/of behandelen van spiermassaverlies. Een mogelijke interventie is intradialytische parenterale voeding (IDPN). Dit is voeding die tijdens de dialyse wordt toegediend. Eerder onderzoek toonde aan dat IDPN kan zorgen voor een positieve eiwitbalans. IDPN lijkt hierdoor een veelbelovende behandeling om verlies van spiermassa in hemodialysepatiënten te voorkomen. Naast voedingsinterventies om de eiwitinname te vergroten, zijn er ook mogelijke voedingsinterventies die de eiwitafbraak kunnen verkleinen en daarmee een positief effect kunnen hebben op de eiwitbalans. Gezien het belang van de spiermassa bij nierfalen- en hemodialysepatiënten is het van essentieel belang dit juist te bepalen. Het doel van de onderzoeken die wij uitvoeren is om effectieve voedingsinterventies te vinden en daarnaast om de juiste methode om spiermassa te meten bij nierfalen- en hemodialysepatiënten te bepalen.
Inleiding
Ruim 12% (2 miljoen mensen) van de Nederlandse bevolking heeft chronische nierschade, 40% (800.000 mensen) daarvan weet dat niet (Nierstichting,2021). Klachten ontstaan vaak pas als de nierfunctie nog maar 30% is (Nierstichting,2021). Mensen met chronische nierschade hebben een verhoogd risico op nierfalen en hart- en vaatziekten (Nierstichting,2021). Elk jaar komen er zo’n 2.000 patiënten met nierfalen bij (Nierstichting,2020). Dat aantal stijgt waarschijnlijk de komende jaren, onder andere door vergrijzing en de toename van mensen met diabetes en hoge bloeddruk. Bij terminaal nierfalen is uiteindelijk nierfunctievervangende therapie noodzakelijk. Transplantatie is niet altijd (direct) mogelijk of gewenst. Dialyse is een belangrijk, maar zwaar alternatief.
In Nederland zijn er ongeveer 6.200 mensen afhankelijk van dialyse (Nierstichting,2020). Er zijn twee manieren van dialyse; hemodialyse (HD) en peritoneaaldialyse (PD). Van de mensen die dialyseren doet 80 procent (ca. 5000 mensen) dat middels HD in een centrum (Nierstichting,2020). Bekend is dat gemiddeld 40% van de hemodialysepatiënten lijdt aan ‘protein-energy wasting’ (PEW), de term voor ondervoeding bij patiënten met nierfalen (Fouque,2008). Dit komt neer op ca. 2000 hemodialysepatiënten in Nederland die lijden aan ondervoeding, wat leidt tot het verlies van spiermassa, spierkracht, verminderde zelfredzaamheid, hogere mortaliteit, meer ziekenhuis opnames en een lagere kwaliteit van leven (Fouque,2008). De relatie tussen spiermassa en kwaliteit van leven betekent dat een interventie die verlies van spiermassa kan voorkomen, ook de kwaliteit van leven kan verbeteren. Dit artikel behandelt de volgende onderwerpen: de rol van voeding bij chronisch en eindstadium nierfalen, het belang van de voedingstoestand bij patiënten met chronisch nierfalen, het effect van voedingsinterventies op de spiermassa bij hemodialyse patiënten en nutritional assessment bij patiënten met nierziekten.
De rol van voeding bij chronisch en eindstadium nierfalen
De nieren hebben verschillende taken, zoals het verwijderen van afvalstoffen en het reguleren van de vocht- en elektrolytenbalans. Daarnaast dragen de nieren bij aan de regulatie van de bloeddruk, maken zij het hormoon erythropoëtine (EPO) aan en reguleren de nieren de zuurtegraad van het lichaam (Nierstichting,2021). Al deze functies houden verband met de voeding en/of de voedingstoestand van de patiënt. De nierfunctie kan bepaald worden met bloed- en urineonderzoek. Hierbij wordt gekeken naar creatinine (restproduct van de stofwisseling in de spieren) en ureum (eindproduct bij de afbraak van eiwitten). Creatinine wordt via de nieren verwijderd en kan dus ook in de urine worden gemeten. In de urine kan ook eiwit worden gevonden wat duidt op nierschade. De indeling van chronische nierschade in verschillende stadia is gebaseerd op de nierfunctie en de aanwezigheid van eiwit in de urine. Als maat voor de nierfunctie wordt de eGFR (estimated glomerular filtration rate) formule gebruikt. Er zijn zes stadia (eGFR > 90 ml/min, eGFR 60 – 89 ml/min, eGFR 45 – 59 ml/min, eGFR 30 – 44 ml/min, eGFR 15 -29 ml/min en eGFR <15 ml/min) voor de nierfunctie en drie voor de aanwezigheid van eiwit in de urine (normaal-licht verhoogd, matig verhoogd en sterk verhoogd) (F.M.S.,2018). In de eGFR-formule wordt spiermassa niet meegenomen, terwijl creatinine in de formule wel een belangrijke rol speelt. Aangezien creatinine het restproduct is van de eiwitmetabolisme kan hierdoor bij patiënten met veel of weinig spiermassa een onder- of overschatting van de nierfunctie ontstaan.
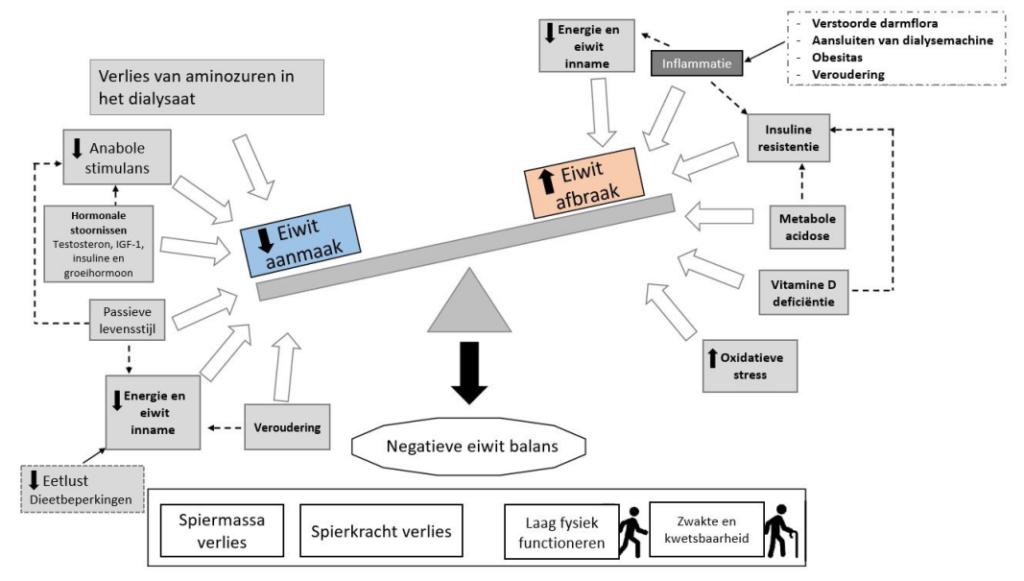
In elk stadium van nierschade speelt voeding een belangrijke rol; zowel in progressie van de nierschade als bij de behandeling ervan. Bekend is dat zout de bloeddruk kan verhogen en dat patiënten met chronische nierschade hier gevoelig voor zijn (McMahon,2013; Meng,2014). Door het opleggen van een zoutbeperking wordt er een bijdrage geleverd aan de bloeddrukregulatie en daardoor aan het verminderen van de progressie van de nierschade. Een andere dieetbeperking die bijdraagt aan de vermindering van progressie in nierschade is een eiwitbeperking. De situatie die in de nier ontstaat bij een te hoge eiwitinname wordt hyperfiltratie genoemd. Een eiwitbeperking zorgt voor een verlaging van de druk in de nieren en draagt daarmee bij aan de remming van achteruitgang in nierfunctie (Kalantar-Zadeh,2018). Gezien het belang van voldoende eiwit in relatie met de voedingstand aan de andere kant, is dit in de praktijk een lastige balans. Wanneer de nierschade toeneemt, neemt de kans op elektrolytenstoornissen ook toe. Naast natrium afkomstig van zout, zijn andere belangrijke elektrolyten in de behandeling van patiënten met nierschade kalium en fosfaat. Afhankelijk van de bloedwaarden, kan het beperken van de inname nodig zijn. Wanneer het ureum in het bloed stijgt, kunnen patiënten last krijgen van uremische klachten; vermoeidheid, misselijkheid, braken en verminderde eetlust. Dit zijn allemaal symptomen die bijdragen aan een verminderde inname van energie en eiwit en dus aan een hoger risico op het ontstaan van ondervoeding en daarmee op het verlies van spiermassa. Verstoring van de zuurgraad van het bloed betekent dat het bloed verzuurt. Dit wordt metabole acidose genoemd. Bekend is dat metabole acidose ook leidt tot een verhoogde eiwitafbraak en daarmee een negatieve eiwitbalans wat zal leiden tot verlies van spiermassa (Sabatino,2020).
Het is dus belangrijk om de voeding aan te passen bij patiënten met nierschade om een bijdrage te leveren aan het remmen van achteruitgang van nierfunctie en aan symptoombestrijding. Uiteindelijk zal een vorm van nierfunctievervangende therapie noodzakelijk zijn. Met een niertransplantatie kan de nierfunctie volledig overgenomen worden, met dialyse kan dit maar beperkt. Hemodialyse neemt 10% tot 15% van de nierfunctie over (Nierstichting,2020). Daarom zal naast de dialysebehandeling een dieet noodzakelijk zijn om ophoping van afvalstoffen tegen te gaan, door de vochtbalans te normaliseren met een vocht- en zoutbeperking en door zorg te dragen voor behoud van de voedingstoestand.
Het belang van de voedingstoestand bij patiënten met chronisch en eindstadium nierfalen
Nierfalen heeft een grote impact op de fysieke en mentale aspecten van de kwaliteit van leven. De kwaliteit van leven is bij patiënten die dialyseren significant slechter dan bij patiënten die een niertransplantatie hebben ondergaan (Liem,2008; Wyld,2012). Patiënten die dialyseren hebben onder andere een grotere kans op vermoeidheid en depressieve klachten in vergelijking met patiënten na een niertransplantatie en met gezonde mensen (van Sandwijk,2019). De voedingstoestand en lichaamssamenstelling zijn nauw geassocieerd met morbiditeit, mortaliteit en kwaliteit van leven (Rambod,2009; Martinson,2014; Marcelli,2015; Stenvinkel,2016). In alle fasen van de nierziekte is het belangrijk om een zo goed mogelijke voedingstoestand te behouden. Zo blijkt dat voedingstoestand voorafgaand aan een niertransplantatie van invloed is op de uitkomsten na de transplantatie. Ondervoeding vóór transplantatie is namelijk geassocieerd met slechtere overleving van de patiënt en van de nieuwe nier (‑Molnar,2011). Daarom is behoud van een optimale voedingstoestand bij patiënten op de wachtlijst voor niertransplantatie van groot belang. Dit betekent dat ook wanneer niertransplantatie niet meer mogelijk is, het voor de kwaliteit van leven van de patiënt van essentieel belang is om in een zo goed mogelijke voedingstoestand te blijven. Spiermassa lijkt hierbij de beste parameter te zijn voor het verband tussen voedingstoestand en (klinische) uitkomsten, waaronder mortaliteit en kwaliteit van leven (Beddhu,2003; Abbott,2004; Kalantar-Zadeh,2010; Noori,2010; Marcelli,2015; Mulasi,2015).
Dialyse is een levensreddende behandeling, maar heeft een grote negatieve gevolgen voor de voedingstoestand. PEW komt voor bij 20 tot 70% van de chronische hemodialysepatiënten, met een gemiddelde van 40% (Fouque,2008). Met de progressie van chronische nierziekte is er een spontane daling van de eiwitinname (Duenhas,2003). Van de patiënten met terminale nierziekte rapporteerde 35-70 procent van de patiënten een slechte eetlust (Bossola,2006). Bovendien leidt een vochtbeperking om intradialytische gewichtstoename te minimaliseren tot een afname van de calorie-inname (Sherman,1995). De dialyseprocedure zelf heeft ook een katabool effect door verminderde eiwitsynthese en als gevolg van het verlies van aminozuren in het dialysaat (Ikizler,2002; Ikizler,2005). Andere factoren die leiden tot spiermassaverlies bij dialyse patiënten zijn acidose, inflammatie, comorbiditeit, gebruik van corticosteroïden en een inactieve levensstijl (Stenvinkel,2005; Fouque,2008). Naast alle mogelijke voedingsinterventies speelt vanwege de inactieve levensstijl, het stimuleren van de patiënt om voldoende te bewegen een belangrijke rol in het behoud van de spiermassa.
Vanwege de relatie tussen de voedingstoestand en spiermassa, morbiditeit, mortaliteit en kwaliteit van leven, kan een interventie om het verlies van spiermassa te voorkomen grote impact hebben op de zelfredzaamheid en de kwaliteit van leven van nierpatiënten.
Nutritional assessment bij patiënten met chronisch en eindstadium nierfalen
Het systematisch beoordelen van de voedingstoestand en voedingsbehoefte wordt ook Nutritional Assessment (NA) genoemd. NA is onderdeel van het diëtistisch onderzoek en helpt bij het vaststellen van de diëtistische diagnose en het behandelplan. Hierin biedt NA objectieve gegevens om de behandeling al dan niet aan te passen. Samengevat worden er op een gestructureerde wijze (subjectief en objectief) metingen gedaan die in te delen zijn in meerdere domeinen: 1) voedselinname, verbruik en verliezen, 2) lichaamssamenstelling, 3) parameters van fysieke functionaliteit en 4) nutriëntenreserves (Gibson,2005).
Van oudsher wordt gewicht(sverloop) gebruikt als parameter voor de lichaamssamenstelling, maar bij patiënten met nierfalen blijkt gewicht geen goede maatstaf, aangezien het gewichtsverlies gemaskeerd kan worden door een toename in vocht en vetmassa, zoals ook blijkt uit ons observationele onderzoek (Visser,2020). Het indirect bepalen van de spiermassa kan met behulp van DEXA, CT-scan, MRI-scan en de Bodpod. Daarnaast zijn er ook dubbel indirecte methoden die afgeleid en gevalideerd zijn op basis van de indirecte methoden, denk hierbij aan huidplooimetingen, omtrekmaten en bio-impedantie analyse.
Een belangrijke aanname bij het meten van lichaamssamenstelling middels bio-impedantie analyse is, dat het lichaam een normale vochtstatus heeft. Voor patiënten met nierfalen klopt deze aanname niet. Het is voor patiënten met nierfalen dus essentieel dat het (overtollige)extracellulaire vocht onderscheiden kan worden van de spiermassa. Gebeurt dit niet, dan wordt het te veel aan vocht aangezien als spiermassa. Dit kan alleen met de BIS die meet op meerdere frequenties (Wabel,2009; Mulasi,2015). Deze methode is gevalideerd voor dialysepatiënten (Wabel,2009).
Er zijn ook andere veelbelovende methodes. Eén van de belangrijkste op het gebied van spiermassa en spierkwaliteit is echografie (Wilkinson,2019; Sahathevan,2020). Hiermee kan vocht beter gedetecteerd worden en niet alleen de spiermassa, maar ook de spierkwaliteit beoordeeld worden, door het bepalen van vetinfiltratie in de spier. Aangezien patiënten met chronisch nierfalen een fenotype van versnelde veroudering vertonen (Gracia-Iguacel,2013), kan worden verwacht dat, net als bij veroudering, een afname van de spierkracht gevonden zal worden. In een dierstudie werd aangetoond, dat in vergelijking met de controlegroep, de spierfunctie van ratten met nierfalen afnam, hoewel de spiermassa niet veranderde. In plaats daarvan werden veranderingen in de kwaliteit van de spieren en een verhoogde spiervezelatrofie waargenomen (Organ,2016). Fahal et al. (Fahal,1997) onderzocht veranderingen in spierzwakte bij HD- en PD-patiënten in vergelijken met gezonde personen door te kijken naar bovenbeenspierkracht en contractiële eigenschappen en naar het type spiervezels middels een spierbiopsie. Gevonden werd, dat de spierkracht bij dialysepatiënten lager was dan bij gezonde personen en dat dialysepatiënten met ondervoeding (o.b.v. SGA) zwakker waren dan dialyse patiënten zonder ondervoeding. Een ander opvallend verschil tussen de dialysepatiënten en de controlegroep was de tragere ontspanning in de spier. Bovendien werd bij 78% van de dialysepatiënten morfologische afwijkingen in de spierbiopten waargenomen, met atrofie in vezeltype I (langzame spiervezels) bij 45% van de patiënten en atrofie in vezeltype II (snelle spiervezels) bij 40% van de patiënten. Daarbij was het aantal vezels met vezeltype II (snelle spiervezels) significant kleiner in de ondervoede dialysegroep dan in de goed gevoede dialysepatiënten. Deze bevindingen bevestigen, dat spiermassa niet de enige bepalende factor is voor de spierkracht, maar ook andere factoren, zoals spierontspanning en spierkwaliteit, een rol spelen. In de cross-sectionele studie van Johansen et al. (Johansen,2003) werd aangetoond dat dialyse-patiënten een lagere spierkracht, spierontspanning en loopsnelheid hadden dan de gezonde controlegroep, terwijl het totale spieroppervlak vergelijkbaar was. Een afname van de kwaliteit van de spieren, veroorzaakt door de infiltratie van vet, lijkt een ontbrekende schakel te zijn (Wilkinson,2019; Sabatino,2020).
Met behulp van de spierechografie meten wij intramusculair vet en maken wij gebruik van een software (Musclesound) om de spierkwaliteit te duiden. Het bepalen van spierkwaliteit met behulp van echografie is nog niet gevalideerd bij patiënten met nierziekten. Daarom voeren wij een validatie studie uit, waarvoor wij aangesloten zijn bij een grotere studie bij patiënten die een niertransplantatie ondergaan. Deze patiënten krijgen bij de opname voor een niertransplantatie een CT-scan abdomen waarbij ook L3-niveau mee gescand wordt. De analyse van CT-scans op L3 niveau dienen dan als gouden standaard voor het bepalen van de hoeveelheden spier- en vetmassa, omdat uit onderzoek blijkt dat de hoeveelheid spieroppervlakte in cm2 op het niveau van lumbale wervel 3 gerelateerd is aan spiermassa in het hele lichaam (Mourtzakis,2008; Schweitzer,2015). Naast de spieroppervlakte kan de oppervlakte van vetweefsel worden bepaald en kan onderscheid worden gemaakt tussen subcutaan vet (onder de huid), visceraal vet (tussen de organen) en intramusculair vet (in de spieren). Daarnaast kan de gemiddelde dichtheid van het spierweefsel worden bepaald. Hoe meer vetinfiltratie er in de spier is, hoe lager de gemiddelde dichtheid. Meer vetinfiltratie is geassocieerd met een verlaagde kwaliteit van de spier (Coen,2012). Binnen 24-uur rondom de CT-scan wordt de echografie uitgevoerd. Op hetzelfde moment doen wij ook een lichaamssamenstelling meting m.b.v. de bio-impedantie spectroscopie (BCM, Fresenius) en meten wij handknijpkracht (Jamar). De opzet van deze studie, met metingen vlak voor een niertransplantatie en follow-up-metingen na de niertransplantatie biedt ons de mogelijkheid om het effect van een niertransplantatie op de spierkwaliteit, lichaamssamenstelling en functionaliteit in de tijd in kaart te brengen. Bekend is, dat patiënten na een transplantatie vaak aankomen in gewicht (Cashion,2007; Aksoy,2016). Nog onvoldoende bekend is, of dit spier- of vetmassa is en al helemaal onbekend is wat er gebeurt met de spierkwaliteit na een niertransplantatie.
Het effect van intradialytische parenterale voeding op de spiermassa bij hemodialyse patiënten
In een observationele studie bij 54 hemodialyse patiënten met een hoge comorbiditeit, gezien een gemiddelde Charlson Comorbidity Index van 9, die 20 weken zijn gevolgd en bij wie om de 4 weken de lichaamssamenstelling en spierkracht is gemeten met behulp van de body composition monitor® (Fresenius Medical Care, Bad Homburg, Germany) en de handknijpkracht meter van JAMAR (hydraulic; Patterson Medical, Warrenville, IL, USA), vonden wij, dat het lichaamsgewicht in 20 weken niet significant afnam (-0,5 kg, p= 0,09), maar dat de patiënten veel spiermassa verloren (-6,5 kg, p= <0,001)(Visser,2020). Het verlies van spiermassa werd gemaskeerd door een toename van de vetmassa (4,5 kg, p= <0,001). De spierkracht nam ook af (-1,9, p=0,002) (Visser,2020). De gevonden resultaten wijzen op zeer nadelige veranderingen in lichaamssamenstelling en spierkracht, en zijn daarmee een extra argument om naar interventies te zoeken die het verlies van spiermassa en spierkracht kunnen beperken en/of voorkomen bij hemodialyse patiënten.
In de zoektocht naar een interventie om spiermassa en spierkracht verlies te beperken en/of te voorkomen zijn wij gestart met parenterale voeding tijdens dialyse (IntraDialytic Parenteral Nutrition, IDPN). Wij gaven in reguliere zorg reeds IDPN aan patiënten die te weinig energie en eiwit binnenkrijgen met orale voeding aangevuld met bijvoeding. Hierbij zagen wij reeds subjectieve verbeteringen, namelijk dat patiënten zich beter voelden, meer energie hadden en dat in sommige gevallen het streefgewicht opgehoogd kon worden. In de literatuur is er echter nog altijd geen eenduidigheid over het effect van IDPN op de voedingstoestand. De conclusie van systematische reviews en meta-analyses naar het effect van IDPN op de voedingstoestand bij hemodialysepatiënten is, dat er een dubbelblinde, placebogecontroleerde studie nodig is (Dukkipati,2010; Sigrist,2010; Sabatino,2014; Tan,2015; Anderson,2019). Deze conclusie gecombineerd met de resultaten uit onze observationele studie was voor ons de aanleiding om een dubbelblinde, gerandomiseerde en placebogecontroleerde interventiestudie met IDPN op te zetten.
In deze studie wordt gedurende een periode van 16 weken het effect van IDPN op de spiermassa, spierkwaliteit en spierkracht en de voedingsinname geëvalueerd met behulp van bio-impedantiespectroscopie, spierechografie, handknijpkracht, voedingsanamnese, eetlust met behulp van de Numeric Rating Scale (NRS), de normalized Protein Catabolc Rate (nPCR), Subjective Global Assessment (SGA) en beweegmonitoring (Activ8). Bovendien wordt er tweemaal een plukje haar afgeknipt om de stresshormonen, en zo het effect van stress op de vetopslag, te kunnen bepalen. Daarnaast wordt het effect op kwaliteit van leven gemeten met behulp van de Kidney Disease Quality of Life (KDQOL) vragenlijst en de Positive And Negative Affect Scale (PANAS) vragenlijst. Om de vier weken is er een meetmoment en per meetmoment wordt bloed afgenomen voor de opslag in een biobank. Deze biobank geeft de mogelijkheid om eventueel achteraf biochemische bepalingen te verrichten.
Tijdens deze dubbelblinde, gerandomiseerde studie krijgen patiënten gedurende 12 weken tijdens dialyse een infuus met 1 L IDPN (Olimel N12®, Baxter BV, Utrecht) (interventie) of 1 L 5% Glucose (controle). Vier weken na de stop van de infusie volgt nog een meetmoment. Dit meetmoment is opgenomen om te onderzoeken of het geven van IDPN een positief effect heeft op de langere termijn.
Om te begrijpen hoe de parenterale voeding tijdens dialyse eventueel kan bijdragen aan het beperken en/of voorkomen van spiermassaverlies, kan het effect van IDPN op de totale eiwitturnover gemeten worden. In een eerdere kleine interventiestudie met stabiele isotopen is aangetoond dat IDPN in een enkele dialysesessie de netto negatieve eiwitbalans, die tijdens de hemodialyse ontstaat, kan omkeren (Pupim,2002). Deze methode vraagt om een zeer specifiek studiedesign, is erg gevoelig voor kleine veranderingen die niet overeenkomen met de dagelijkse realiteit (stikt vasten, beweging) en het gebruik van een enkele dialysesessie geeft nauwelijks informatie over de effecten op langere termijn. Om het effect te meten en bovenstaande beperkingen te voorkomen, zullen wij een studie uitvoeren waarbij deelnemers gedurende 2 weken dubbel gelabeld water (deuterium oxide) gebruiken, waarbij in één week IDPN wordt toegediend en één week geen infusie. Door het gebruik van dubbel gelabeld water kan de eiwitaanmaak nauwkeurig gemeten worden in spierbiopten en zo een uitspraak gedaan worden over de mogelijk positieve effecten van IDPN op de totale eiwitturnover (Wilkinson,2017). Daarnaast zullen wij ook het verlies van aminozuren tijdens dialyse meten door gebruik te maken van een verzamelbak. Hierin wordt al het dialysaat verzameld en kan dus nauwkeurig achteraf het verlies van aminozuren worden gemeten. Verder zullen activiteit (activ8), het rustmetabolisme (indirecte calorimetrie), voedingsinname en lichaamssamenstelling worden gemeten. Bovendien zal het effect van IDPN op hemodynamische parameters onderzocht worden, aangezien infusie van een liter vloeistof tijdens de hemodialyse bij sommige patiënten zou kunnen leiden tot hemodynamische instabiliteit, wat mogelijk versterkt wordt door het lage natrium- en chloridegehalte van de geïnfundeerde vloeistof. De resultaten van het hemodynamische effect van IDPN kan de zorgen rondom de implementatie van IDPN in sommige patiëntengroepen eventueel wegnemen. Tot op heden zijn er geen gepubliceerde gegevens over het effect van IDPN op hemodynamische parameters tijdens de hemodialyse.
Meer dan eiwitinterventies
In patiënten met nierfalen is het gezien de associatie van eiwitinname en hyperfiltratie belangrijk om verder te kijken dan alleen interventies met eiwit om de voedingstoestand te verbeteren. In de zoektocht naar effectieve interventies om de voedingstoestand van nierpatiënten te verbeteren doet het Erasmus MC ook mee aan een grote landelijke studie naar het effect van kaliumsuppletie op de nierfunctie, het K+onsortium onderzoek (Gritter,2018). Een veel voorkomende bijwerking van nierfunctiestoornissen is het ontwikkelen van metabole acidose. Bekend is dat metabole acidose leidt tot een hogere eiwitafbraak (Łoniewski,2014; Amodu,2016; Sabatino,2020). Er zijn meerdere onderzoeken die laten zien dat het corrigeren van metabole acidose een gunstig effect heeft op de voedingstoestand bij patiënten met nierfalen (de Brito-Ashurst,2009; Goraya,2019; Bernabe-Ortiz,2020; Dubey,2020). deBrito et al. (de Brito-Ashurst,2009) laten zien dat wanneer het zuur-base- evenwicht gecorrigeerd wordt, daarmee ook parameters van de voedingstoestand zoals eiwitinname en bovenarmspieromtrek verbeteren. Goraya et al. (Goraya,2019) zagen dat een interventie met groente en fruit voor het corrigeren van metabole acidose een beter effect had op cardiovasculair risico dan het corrigeren van de metabole acidose met natriumbicarbonaat. Het corrigerende effect op de metabole acidose was hetzelfde tussen de twee groepen. In het K+onsortium is een van de interventies kaliumcitraat, waarvan de verwachting is dat dit metabole acidose kan corrigeren en hiermee mogelijk een gunstig effect heeft op de voedingstoestand. Om dit effect te kunnen onderzoeken meten wij in het kader van deze studie de spiermassa en -kracht en wordt de voedingstoestand geëvalueerd met behulp van bio-impedantie spectroscopie, handknijpkracht, voedingsanamnese, eetlust (NRS) en de nPCR.
Onderzoekslijn “Voeding en Nierziekten”
Samenvattend hebben wij in een observationele studie in hemodialysepatiënten gevonden dat er een flink verlies van spiermassa en spierkracht optreedt. Deze bevindingen tonen de relevantie aan van het meten van de lichaamssamenstelling bij alle hemodialysepatiënten. In combinatie met de groeiende hoeveelheid gegevens die een verband aantonen tussen spiermassa en klinische resultaten bij dialysepatiënten vragen de resultaten van onze observationele studie om studies die analyseren of voedingsinterventies, zoals orale voedingssupplementen of IDPN, in staat zijn om spiermassaverlies te voorkomen en/of te behandelen.
Dit promotietraject moet niet het einde zijn van een periode, maar juist de start van een structurele onderzoekslijn naar de relatie tussen voeding en nierziekten. De bedoeling is dat dit promotietraject als vliegwiel zal dienen voor vervolgonderzoek op het gebied van nutritional assessment en voedingsinterventies. Hiervoor hebben wij de onderzoekslijn “Voeding en Nierziekten” opgezet. Binnen deze onderzoekslijn richten wij ons op het werken aan ‘evidence-based’ voedingstherapieën voor deze patiëntenpopulatie, met een centrale rol voor ‘nutritional assessment‘ in de diagnostiek en het meten van het effect van de dieetbehandeling.
Dankwoord
Veel dank aan de volgende mensen in verband met hun bijdrage aan en de samenwerking in dit promotietraject en de onderzoekslijn:
Joanne F. Olieman1, Leontien J. Koene1, Gerdien M. Koeling – van Doorn1, Isabel M. van Ruijven1, Lucie Venrooij1, Sanne C.M. Boeters1, Jeroen Molinger2, David Severs3, Ewout J. Hoorn3.
1 Department of Internal Medicine, Division of Dietetics, Erasmus MC, University Medical Center, 3015 GD Rotterdam, The Netherlands
2 Department of Intensive Care Medicine, Erasmus MC, University Medical Center, 3015 GD Rotterdam, The Netherlands
3 Department of Internal Medicine, Division of Nephrology and Transplantation, Erasmus MC, University Medical Center, 3015 GD Rotterdam, The Netherlands
Referenties:
Abbott, K. C., C. W. Glanton, F. C. Trespalacios, D. K. Oliver, M. I. Ortiz, L. Y. Agodoa, D. F. Cruess and P. L. Kimmel (2004). “Body mass index, dialysis modality, and survival: analysis of the United States renal data system dialysis morbidity and mortality wave II study.” Kidney international 65(2): 597-605.
Aksoy, N. (2016). “Weight gain after kidney transplant.” Exp Clin Transplant 14(Suppl 3): 138-140.
Amodu, A. and M. K. Abramowitz (2016). Effects of metabolic acidosis on skeletal muscle. Metabolic Acidosis, Springer: 101-110.
Anderson, J., K. Peterson, D. Bourne and E. Boundy (2019). “Effectiveness of intradialytic parenteral nutrition in treating protein-energy wasting in hemodialysis: a rapid systematic review.” Journal of Renal Nutrition 29(5): 361-369.
Beddhu, S., L. M. Pappas, N. Ramkumar and M. Samore (2003). “Effects of body size and body composition on survival in hemodialysis patients.” Journal of the American Society of Nephrology 14(9): 2366-2372.
Bernabe-Ortiz, A., V. G. S. y Rosas, V. Ponce-Lucero, M. K. Cárdenas, R. M. Carrillo-Larco, F. Diez-Canseco, M. A. Pesantes, K. A. Sacksteder, R. H. Gilman and J. J. Miranda (2020). “Effect of salt substitution on community-wide blood pressure and hypertension incidence.” Nature medicine 26(3): 374-378.
Bossola, M., L. Tazza, S. Giungi and G. Luciani (2006). “Anorexia in hemodialysis patients: an update.” Kidney international 70(3): 417-422.
Cashion, A. K., Z. V. Sánchez, P. A. Cowan, D. K. Hathaway, A. L. Costello and A. O. Gaber (2007). “Changes in weight during the first year after kidney transplantation.” Progress in transplantation 17(1): 40-47.
Coen, P. M. and B. H. Goodpaster (2012). “Role of intramyocelluar lipids in human health.” Trends in Endocrinology & Metabolism 23(8): 391-398.
de Brito-Ashurst, I., M. Varagunam, M. J. Raftery and M. M. Yaqoob (2009). “Bicarbonate supplementation slows progression of CKD and improves nutritional status.” Journal of the American Society of Nephrology 20(9): 2075-2084.
Dubey, A. K., J. Sahoo, B. Vairappan, S. Haridasan, S. Parameswaran and P. S. Priyamvada (2020). “Correction of metabolic acidosis improves muscle mass and renal function in chronic kidney disease stages 3 and 4: a randomized controlled trial.” Nephrology Dialysis Transplantation 35(1): 121-129.
Duenhas, M. R., S. A. Draibe, C. M. Avesani, R. Sesso and L. Cuppari (2003). “Influence of renal function on spontaneous dietary intake and on nutritional status of chronic renal insufficiency patients.” European journal of clinical nutrition 57(11): 1473-1478.
Dukkipati, R., K. Kalantar-Zadeh and J. D. Kopple (2010). “Is there a role for intradialytic parenteral nutrition? A review of the evidence.” American journal of kidney diseases 55(2): 352-364.
F.M.S. (2018). “Federatie medisch specialisten, diagnostiek en stadiering bij cns.” from https://richtlijnendatabase.nl/richtlijn/chronische_nierschade_cns/diagnostiek_en_stadiering_bij_cns/bepaling_van_nierfunctie_en_albuminurie.html.
Fahal, I. H., G. M. Bell, J. M. Bone and R. H. Edwards (1997). “Physiological abnormalities of skeletal muscle in dialysis patients.” Nephrology, Dialysis, Transplantation: Official Publication Of The European Dialysis And Transplant Association-European Renal Association 12(1): 119-127.
Fouque, D., K. Kalantar-Zadeh, J. Kopple, N. Cano, P. Chauveau, L. Cuppari, H. Franch, G. Guarnieri, T. A. Ikizler and G. Kaysen (2008). “A proposed nomenclature and diagnostic criteria for protein–energy wasting in acute and chronic kidney disease.” Kidney international 73(4): 391-398.
Gibson, R. S. (2005). Principles of nutritional assessment, Oxford university press, USA.
Goraya, N., Y. Munoz-Maldonado, J. Simoni and D. E. Wesson (2019). “Fruit and vegetable treatment of chronic kidney disease-related metabolic acidosis reduces cardiovascular risk better than sodium bicarbonate.” American journal of nephrology 49(6): 438-448.
Gracia-Iguacel, C., A. R. Qureshi, C. M. Avesani, O. Heimbürger, X. Huang, B. Lindholm, P. Bárány, A. Ortiz, P. Stenvinkel and J. J. Carrero (2013). “Subclinical versus overt obesity in dialysis patients: more than meets the eye.” Nephrology Dialysis Transplantation 28(suppl_4): iv175-iv181.
Gritter, M., L. Vogt, S. M. H. Yeung, R. D. Wouda, C. R. B. Ramakers, M. H. de Borst, J. I. Rotmans and E. J. Hoorn (2018). “Rationale and design of a randomized placebo-controlled clinical trial assessing the renoprotective effects of potassium supplementation in chronic kidney disease.” Nephron 140(1): 48-57.
Ikizler, T. A. (2005). “Effects of hemodialysis on protein metabolism.” Journal of renal nutrition 15(1): 39-43.
Ikizler, T. A., L. B. Pupim, J. R. Brouillette, D. K. Levenhagen, K. Farmer, R. M. Hakim and P. J. Flakoll (2002). “Hemodialysis stimulates muscle and whole body protein loss and alters substrate oxidation.” American Journal of Physiology-Endocrinology And Metabolism 282(1): E107-E116.
Johansen, K. L., T. Shubert, J. Doyle, B. Soher, G. K. Sakkas and J. A. Kent-Braun (2003). “Muscle atrophy in patients receiving hemodialysis: effects on muscle strength, muscle quality, and physical function.” Kidney international 63(1): 291-297.
Kalantar-Zadeh, K. and D. Fouque (2018). “Nutritional management of chronic kidney disease.” The New England journal of medicine 378(6): 584-585.
Kalantar-Zadeh, K., E. Streja, C. P. Kovesdy, A. Oreopoulos, N. Noori, J. Jing, A. R. Nissenson, M. Krishnan, J. D. Kopple and R. Mehrotra (2010). The obesity paradox and mortality associated with surrogates of body size and muscle mass in patients receiving hemodialysis. Mayo Clinic Proceedings, Elsevier.
Liem, Y. S., J. L. Bosch and M. G. M. Hunink (2008). “Preference-based quality of life of patients on renal replacement therapy: a systematic review and meta-analysis.” Value in Health 11(4): 733-741.
Łoniewski, I. and D. E. Wesson (2014). “Bicarbonate therapy for prevention of chronic kidney disease progression.” Kidney international 85(3): 529-535.
Marcelli, D., L. A. Usvyat, P. Kotanko, I. Bayh, B. Canaud, M. Etter, E. Gatti, A. Grassmann, Y. Wang and C. Marelli (2015). “Body composition and survival in dialysis patients: results from an international cohort study.” Clinical journal of the American Society of Nephrology: CJN. 08550814.
Martinson, M., T. A. Ikizler, G. Morrell, G. Wei, N. Almeida, R. L. Marcus, R. Filipowicz, T. H. Greene and S. Beddhu (2014). “Associations of body size and body composition with functional ability and quality of life in hemodialysis patients.” Clinical Journal of the American Society of Nephrology 9(6): 1082-1090.
McMahon, E. J., J. D. Bauer, C. M. Hawley, N. M. Isbel, M. Stowasser, D. W. Johnson and K. L. Campbell (2013). “A randomized trial of dietary sodium restriction in CKD.” Journal of the American Society of Nephrology 24(12): 2096-2103.
Meng, L., B. Fu, T. Zhang, Z. Han and M. Yang (2014). “Salt sensitivity of blood pressure in non-dialysis patients with chronic kidney disease.” Renal failure 36(3): 345-350.
Molnar, M. Z., M. E. Czira, A. Rudas, A. Ujszaszi, A. Lindner, K. Fornadi, I. Kiss, A. Remport, M. Novak and S. H. Kennedy (2011). “Association of the malnutrition-inflammation score with clinical outcomes in kidney transplant recipients.” American journal of kidney diseases 58(1): 101-108.
Molnar, M. Z., C. P. Kovesdy, S. Bunnapradist, E. Streja, R. Mehrotra, M. Krishnan, A. R. Nissenson and K. Kalantar‐Zadeh (2011). “Associations of pretransplant serum albumin with post‐transplant outcomes in kidney transplant recipients.” American journal of transplantation 11(5): 1006-1015.
Mourtzakis, M., C. M. M. Prado, J. R. Lieffers, T. Reiman, L. J. McCargar and V. E. Baracos (2008). “A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care.” Applied Physiology, Nutrition, and Metabolism 33(5): 997-1006.
Mulasi, U., A. J. Kuchnia, A. J. Cole and C. P. Earthman (2015). “Bioimpedance at the bedside: current applications, limitations, and opportunities.” Nutrition in Clinical Practice 30(2): 180-193.
Nierstichting. (2020). “Nierstichting, Feiten en cijfers.” from https://www.nierstichting.nl/leven-met-een-nierziekte/feiten-en-cijfers/.
Nierstichting. (2021). “Nierstichting, hoe werken je nieren.” from https://nierstichting.nl/over-nieren/hoe-werken-je-nieren/.
Nierstichting. (2021). “Nierstichting, hoe werken je nieren, feiten en cijfers.” from https://nierstichting.nl/over-nieren/hoe-werken-je-nieren/feiten-en-cijfers/.
Noori, N., J. D. Kopple, C. P. Kovesdy, U. Feroze, J. J. Sim, S. B. Murali, A. Luna, M. Gomez, C. Luna and R. Bross (2010). “Mid-arm muscle circumference and quality of life and survival in maintenance hemodialysis patients.” Clinical Journal of the American Society of Nephrology 5(12): 2258-2268.
Organ, J. M., A. Srisuwananukorn, P. Price, J. E. Joll, K. C. Biro, J. E. Rupert, N. X. Chen, K. G. Avin, S. M. Moe and M. R. Allen (2016). “Reduced skeletal muscle function is associated with decreased fiber cross-sectional area in the Cy/+ rat model of progressive kidney disease.” Nephrology Dialysis Transplantation 31(2): 223-230.
Pupim, L. B., P. J. Flakoll, J. R. Brouillette, D. K. Levenhagen, R. M. Hakim and T. A. Ikizler (2002). “Intradialytic parenteral nutrition improves protein and energy homeostasis in chronic hemodialysis patients.” The Journal of clinical investigation 110(4): 483-492.
Rambod, M., R. Bross, J. Zitterkoph, D. Benner, J. Pithia, S. Colman, C. P. Kovesdy, J. D. Kopple and K. Kalantar-Zadeh (2009). “Association of Malnutrition-Inflammation Score with quality of life and mortality in hemodialysis patients: a 5-year prospective cohort study.” American Journal of Kidney Diseases 53(2): 298-309.
Sabatino, A., L. Cuppari, P. Stenvinkel, B. Lindholm and C. M. Avesani (2020). “Sarcopenia in chronic kidney disease: what have we learned so far?” Journal of Nephrology: 1-26.
Sabatino, A., G. Regolisti, E. Antonucci, A. Cabassi, S. Morabito and E. Fiaccadori (2014). “Intradialytic parenteral nutrition in end-stage renal disease: practical aspects, indications and limits.” Journal of nephrology 27(4): 377-383.
Sahathevan, S., B.-H. Khor, B. K. S. Singh, A. Sabatino, E. Fiaccadori, Z. A. M. Daud, M. S. Ali, S. S. Narayanan, D. Tallman and K. Chinna (2020). “Association of Ultrasound-Derived Metrics of the Quadriceps Muscle with Protein Energy Wasting in Hemodialysis Patients: A Multicenter Cross-Sectional Study.” Nutrients 12(11): 3597.
Schweitzer, L., C. Geisler, M. Pourhassan, W. Braun, C.-C. Glüer, A. Bosy-Westphal and M. J. Müller (2015). “What is the best reference site for a single MRI slice to assess whole-body skeletal muscle and adipose tissue volumes in healthy adults?” The American journal of clinical nutrition 102(1): 58-65.
Sherman, R. A., R. P. Cody, M. E. Rogers and J. C. Solanchick (1995). “Interdialytic weight gain and nutritional parameters in chronic hemodialysis patients.” American Journal of Kidney Diseases 25(4): 579-583.
Sigrist, M. K., A. Levin and A. M. Tejani (2010). “Systematic review of evidence for the use of intradialytic parenteral nutrition in malnourished hemodialysis patients.” Journal of Renal Nutrition 20(1): 1-7.
Stenvinkel, P. (2005). “Inflammation in end-stage renal disease–a fire that burns within.” Cardiovascular Disorders in Hemodialysis 149: 185-199.
Stenvinkel, P., J. J. Carrero, F. Von Walden, T. A. Ikizler and G. A. Nader (2016). “Muscle wasting in end-stage renal disease promulgates premature death: established, emerging and potential novel treatment strategies.” Nephrology Dialysis Transplantation 31(7): 1070-1077.
Tan, T. and R. Debajyoti (2015). “Intradialytic Parenteral Nutrition (IDPN): An evidence based review.” Journal of Renal Nutrition and Metabolism 1(3): 117-117.
van Sandwijk, M. S., D. Al Arashi, F. M. van de Hare, J. M. R. van der Torren, M.-J. Kersten, J. A. Bijlsma, I. J. M. Ten Berge and F. J. Bemelman (2019). “Fatigue, anxiety, depression and quality of life in kidney transplant recipients, haemodialysis patients, patients with a haematological malignancy and healthy controls.” Nephrology Dialysis Transplantation 34(5): 833-838.
Visser, W. J., A. M. E. Egmond, R. Timman, D. Severs and E. J. Hoorn (2020). “Risk Factors for Muscle Loss in Hemodialysis Patients with High Comorbidity.” Nutrients 12(9): 2494.
Wabel, P., P. Chamney, U. Moissl and T. Jirka (2009). “Importance of whole-body bioimpedance spectroscopy for the management of fluid balance.” Blood purification 27(1): 75-80.
Wilkinson, D. J., M. S. Brook, K. Smith and P. J. Atherton (2017). “Stable isotope tracers and exercise physiology: past, present and future.” The Journal of physiology 595(9): 2873-2882.
Wilkinson, T. J., D. W. Gould, D. G. D. Nixon, E. L. Watson and A. C. Smith (2019). “Quality over quantity? Association of skeletal muscle myosteatosis and myofibrosis on physical function in chronic kidney disease.” Nephrology Dialysis Transplantation 34(8): 1344-1353.
Wyld, M., R. L. Morton, A. Hayen, K. Howard and A. C. Webster (2012). “A systematic review and meta-analysis of utility-based quality of life in chronic kidney disease treatments.” PLoS Med 9(9): e1001307.




