
Medische voedingstherapie bij patiënten met acute myeloïde leukemie
29 december 2025Rianne van Lieshout, diëtist in het Máxima MC promoveerde op 4 juli 2025 op het proefschrift Food for Thought; medical nutrition therapy in acute myeloid leukemia patients during intensive treatment.

Haar onderzoek richtte zich op het verbeteren van voedingszorg voor AML-patiënten tijdens intensieve behandeling, met aandacht voor het gebruik van medische voeding en factoren die richtlijnnaleving beïnvloeden. Daarnaast onderzocht zij hoe een proactieve versus afwachtende voedingsaanpak samenhangt met veranderingen in lichaamssamenstelling en klinische uitkomsten tijdens chemotherapie.
Inleiding
Acute myeloïde leukemie (AML) is de meest voorkomende vorm van acute leukemie bij volwassenen, met jaarlijks circa 900 nieuwe diagnoses in Nederland (Integraal Kankercentrum Nederland, 2023). De enige behandeling met kans op genezing bestaat uit hoge dosis chemotherapie, vaak gevolgd door een hematopoëtische stamceltransplantatie (HSCT) (HOVON, 2021). Deze intensieve behandelingen gaan gepaard met ingrijpende bijwerkingen. Vooral verminderde eetlust, smaakveranderingen en gastro-intestinale klachten zoals misselijkheid, braken, mucositis en diarree kunnen de voedselinname en/of -absorptie negatief beïnvloeden en leiden tot ondervoeding (Baumgartner, 2017; Walrath, 2015).
Ondervoeding bij AML-patiënten is geassocieerd met slechtere overlevingskansen, een hoger recidiefrisico, meer complicaties, langere ziekenhuisopnames, toegenomen vermoeidheid, functionele achteruitgang en een verminderde kwaliteit van leven (Anderson, 2019; Baumgartner, 2017; Brauer, 2021; Deluche, 2017; Morishita, 2012). Daarom adviseren de voedingsrichtlijnen van ESPEN en EBMT (European Societies for Clinical Nutrition and Metabolism and for Blood and Marrow Transplantation) om medische voeding (sondevoeding of parenterale voeding) te starten bij onvoldoende orale inname (Arends, 2017; Baumgartner, 2019).
Hoewel eerdere richtlijnen parenterale voeding als eerste keuze aanraadden vanwege mucositis en het bloedingsrisico bij sondeplaatsing, adviseren de recentste ESPEN/EBMT-richtlijnen sondevoeding als eerste optie (Arends, 2006 & 2017; Baumgartner, 2019; Muscaritoli, 2021). Dit omdat verschillende studies laten zien dat sondevoeding mogelijk een gunstige invloed heeft op de darmintegriteit en minder complicaties geeft (Baumgartner, 2017; Seguy, 2012; Guieze, 2014; Andersen, 2020 & 2024, Beckerson, 2019, Zama, 2021). Parenterale voeding wordt alleen geadviseerd bij ernstige gastro-intestinale problemen (Arends, 2017; Baumgartner, 2019). Voedingsinterventies zouden vooral gericht moeten zijn op het behoud van spiermassa, omdat verlies hiervan negatieve effecten heeft op fysiek functioneren, complicaties en mortaliteit (Arends, 2017). Daarnaast zijn er aanwijzingen dat behoud van vetmassa belangrijk kan zijn voor overleving (Jung, 2021).
Er was nog weinig bekend over de naleving van de ESPEN/EBMT-voedingsrichtlijnen tijdens intensieve AML-behandeling in Nederland en over de invloed van verschillende strategieën ten aanzien van medische voeding op lichaamssamenstelling en lichamelijke en klinische uitkomsten van patiënten.
Doel van het onderzoek
Het eerste doel was inzicht krijgen in de huidige voedingszorg tijdens intensieve behandeling van AML-patiënten, met speciale aandacht voor het gebruik van medische voeding en de factoren die naleving van voedingsrichtlijnen bevorderen of belemmeren. Het tweede doel was te onderzoeken hoe een proactieve aanpak ten aanzien van medische voeding versus een afwachtende aanpak (alleen medische voeding bij uitzonderlijke en ernstige gevallen) samenhangt met veranderingen in lichaamssamenstelling, en met fysieke en klinische uitkomsten tijdens intensieve chemotherapie.
Opzet van het onderzoek
Via een landelijke inventarisatie is in kaart gebracht hoe voedingszorg bij intensieve AML-behandeling in Nederland is georganiseerd, met specifieke aandacht voor het gebruik van medische voeding en de naleving van de ESPEN/EBMT-richtlijn. Semigestructureerde interviews en vragenlijsten bij patiënten en zorgprofessionals (diëtisten, verpleegkundigen en hematologen) gaven inzicht in factoren die de naleving van de richtlijnen bevorderen of belemmeren, evenals ervaringen en opvattingen over proactieve versus afwachtende strategieën voor medische voeding (sonde- en parenterale voeding).
In retrospectieve en prospectieve observationele multicenterstudies werden ziekenhuizen met een proactieve aanpak ten aanzien van medische voeding vergeleken met een centrum met een afwachtende aanpak, waarbij de samenhang tussen voedingsstrategie, veranderingen in lichaamssamenstelling en klinische en fysieke uitkomsten van AML-patiënten werd onderzocht.
Belangrijkste uitkomsten
De landelijke inventarisatie liet duidelijke verschillen zien tussen ziekenhuizen, met name wat betreft het gebruik van medische voeding. De startcriteria varieerden aanzienlijk, net als het type voeding: slechts enkele ziekenhuizen pasten sondevoeding toe, terwijl de meeste de voorkeur gaven aan parenterale voeding en één een afwachtende aanpak hanteerde. Belangrijkste reden voor de beperkte naleving van de ESPEN/EBMT-richtlijnen voor sondevoeding waren zorgen over tolerantie en uitvoerbaarheid. Eenduidigheid in voedingszorg tussen ziekenhuizen is belangrijk, omdat verschillen bij patiënten leidden tot verwarring en verminderd vertrouwen in de zorg.
Voor meer uniformiteit en een betere naleving van de voedingsrichtlijnen is volgens zorgprofessionals meer wetenschappelijk bewijs nodig, grotere bekendheid met de voedingsrichtlijnen, een sterkere samenwerking en positieve praktijkervaringen met sondevoeding tijdens intensieve AML-behandeling.
De multicenterstudies leverden duidelijke aanwijzingen dat een proactieve aanpak van medische voeding gunstig is. AML-patiënten bereikten bij deze aanpak, vergeleken met een afwachtende strategie, beter hun energie- en eiwitbehoefte, behielden beter hun gewicht met name door behoud van vetmassa, en ervaarden meer mentale rust. Daarnaast werd een proactieve aanpak geassocieerd met minder ernstige ondervoeding, voedingsklachten en complicaties, en met een kortere opnameduur. Het behoud van vet- en vetvrije massa hing bovendien samen met verbeterd lichamelijk functioneren, minder dagen met koorts, verminderde vermoeidheid en kortere ziekenhuisopnames.
In het ‘afwachtende ziekenhuis’ namen spierkracht en lichamelijk functioneren af bij verlies van spiermassa, terwijl ze in de proactieve ziekenhuizen gelijk bleven bij een vergelijkbaar spierverlies. Dit suggereert dat adequate voeding spierkracht en lichamelijk functioneren gunstig kan beïnvloeden, zelfs bij spierverlies.
Aanbevelingen voor de praktijk
Voor de praktijk worden de volgende aanbevelingen gedaan:
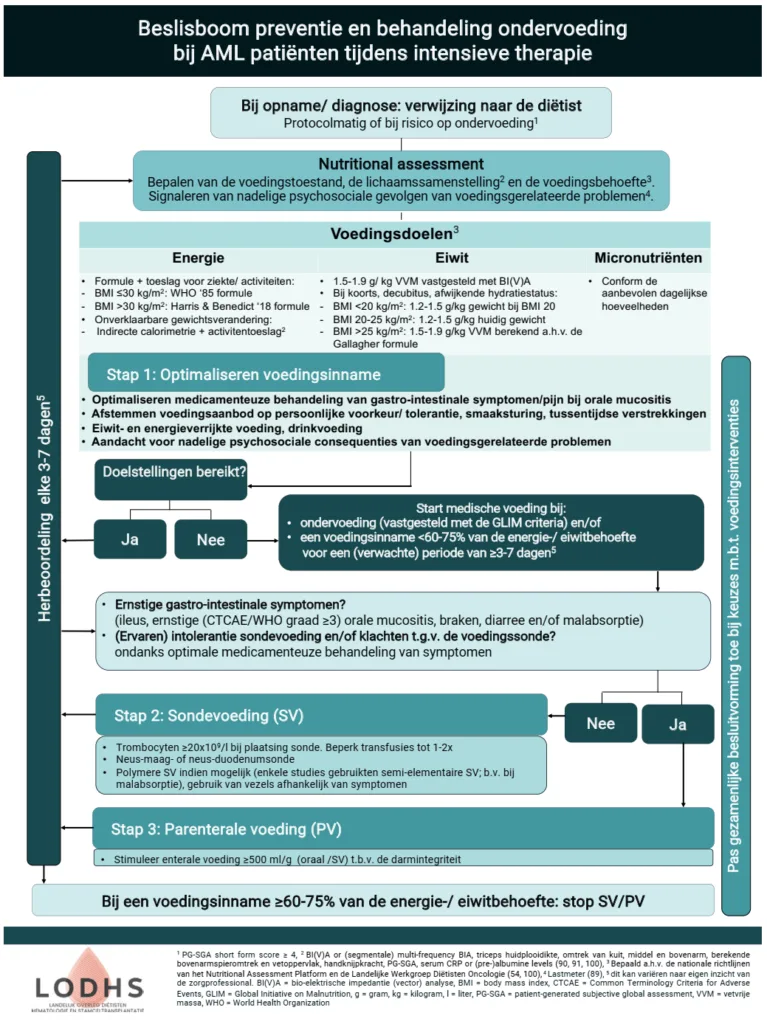
Proactief voedingsbeleid: Verwijs standaard naar de diëtist, omdat intensieve AML-behandelingen gepaard gaan met een hoog risico op ondervoeding door de vele bijwerkingen. Start medische voeding zodra de orale inname <60–75% van de behoefte is voor een verwachte periode van ≥3–7 dagen. Om samen met de patiënt (shared-decision making) en andere zorgprofessionals beslissingen te nemen over het gebruik van medische voeding kan de beslisboom ‘preventie en behandeling ondervoeding bij AML-patiënten tijdens intensieve therapie’ hulp bieden (Figuur 1).
Monitoring lichaamssamenstelling: Gebruik waar mogelijk methoden zoals multifrequency bio-elektrische impedantieanalyse of echografie (Barazzoni, 2022), kuitomtrek, bovenarm(spier)omtrek, tricepshuidplooidikte, bovenarmvetoppervlakte en middelomtrek om veranderingen in spier- én vetmassa in kaart te brengen.
Scholing en samenwerking: Investeer in het kennis en interprofessionele afstemming ten aanzien voedingsrichtlijnen en het gebruik van medische voeding met andere zorgprofessionals. Gebruik als basis de beslisboom (Figuur 1).

Opnemen in zorgpaden: Borg voedingszorg in protocollen en tumorspecifieke zorgpaden in ziekenhuizen.
Opvallend
Een opvallende bevinding was dat niet alleen vetvrije-/spiermassa, maar ook vetmassa een waardevolle parameter bleek om te monitoren. Literatuur laat bovendien zien dat een te lage vetmassa (‘adipopenie’), net als sarcopenie, ongunstig is voor prognose en behandeluitkomsten (Jung, 2021; Nakamura, 2019). Opvallend was verder dat er geen verschil in verlies van vetvrije-/spiermassa werd gevonden tussen de proactieve en afwachtende voedingsaanpak. Dit suggereert dat multimodale interventies mogelijk nodig zijn, waarin specifieke voeding (bijvoorbeeld verrijkt met omega-3-vetzuren, vertakte-keten aminozuren en/of hydroxymethylbutyraat) wordt gecombineerd met fysieke training en mogelijk medicamenteuze of anti-inflammatoire therapieën (Orsso, 2024; Persoon, 2013; Morales-Rodriguez, 2022).
Toekomstig onderzoek zou zich tevens kunnen richten op prehabilitatie voorafgaand aan een stamceltransplantatie. Daarnaast is meer onderzoek nodig naar de haalbaarheid en voordelen van enterale versus parenterale voeding tijdens intensieve AML-behandelingen en de rol van het darmmicrobioom (Zama, 2021; Andersen, 2020b).
Het proefschrift is hier te lezen

Dit artikel is eerder verschenen in het vaktijdschrift Voeding & Visie. Diëtisten in Nederland kunnen het tijdschrift kosteloos ontvangen. Niet ontvangen? Abonneren kan door hier te klikken.
Referenties
- Andersen S, et al. (2024). Proactive enteral nutrition for patients undergoing allogeneic stem cell transplantation- implementation and clinical outcomes. European Journal of Clinical Nutrition, 78(3), 251-6.
- Andersen S, et al. (2020). Tolerability of proactive enteral nutrition post allogeneic haematopoietic progenitor cell transplant: A randomised comparison to standard care. Clinical Nutrition, 39(5), 1364-70
- Andersen S, et al. (2020b). Pilot study investigating the effect of enteral and parenteral nutrition on the gastrointestinal microbiome post-allogeneic transplantation. British Journal of Haematology, 188(4), 570-81.
- Arends J., et al. (2017). ESPEN guidelines on nutrition in cancer patients. Clinical Nutrition, 36(1), 11–48.
- Barazzoni R, Jensen GL, Correia M, et al. (2022). Guidance for assessment of the muscle mass phenotypic criterion for the Global Leadership Initiative on Malnutrition (GLIM) diagnosis of malnutrition. Clinical Nutrition, 41(6), 1425-33.
- Baumgartner A., et al. (2016). Association of nutritional parameters with clinical outcomes in patients with acute myeloid leukemia undergoing hematopoietic stem cell transplantation. Annals of Nutrition & Metabolism, 69(2), 89–98.
- Baumgartner A, et al. (2017). Revisiting nutritional support for allogeneic hematologic stem cell transplantation-a systematic review. Bone Marrow Transplantation, 2017, 52(4), 506-13.
- Baumgartner A, et al., editors. (2019). The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. Cham (CH), p. 171-6.
- Beckerson J, et al. (2019). Impact of route and adequacy of nutritional intake on outcomes of allogeneic haematopoietic cell transplantation for haematologic malignancies. Clinical Nutrition, 38(2), 738-44.
- Integraal Kankercentrum Nederland. (2023). Nederlandse Kanker Registratie (NKR). Geraadpleegd op 22 augustus 2024 van www.iknl.nl/nkr-cijfers
- Deluche E., et al. (2017). Assessment of the nutritional status of adult patients with acute myeloid leukemia during induction chemotherapy. Nutrition, 41, 120–125.
- Guieze R, et al. (2014). Enteral versus parenteral nutritional support in allogeneic haematopoietic stem-cell transplantation. Clinical Nutrition, 2014, 33(3), 533-8.
- HOVON. (2021). Treatment guideline AML. Geraadpleegd op 22 augustus 2024 van https://hovon.nl/en/treatment-guidelines/leukemia
- Jung J., et al. (2021). Prediction of clinical outcomes through assessment of sarcopenia and adipopenia using computed tomography in adult patients with acute myeloid leukemia. International Journal of Hematology, 114(1), 44–52.
- Morales-Rodriguez E., et al. (2022). Effects of exercise programs on physical factors and safety in adult patients with cancer and hematopoietic stem cell transplantation: A systematic review. International Journal of Environmental Research and Public Health, 19(3).
- Muscaritoli, M., et al. (2021). ESPEN practical guideline: Clinical nutrition in cancer. Clinical Nutrition, 40(5), 2898–2913.
- Nakamura N., et al. (2019). Prognostic impact of skeletal muscle assessed by computed tomography in patients with acute myeloid leukemia. Annals of Hematology, 98(2), 351-9.
- Orsso CE., et al. (2024). Effects of high-protein supplementation during cancer therapy: a systematic review and meta-analysis. American Journal of Clinical Nutrition, 120(6), 1311-24.
- Persoon S., et al. (2013). Effects of exercise in patients treated with stem cell transplantation for a hematologic malignancy: A systematic review and meta-analysis. Cancer Treatment Reviews, 39(6), 682–690.
- Rupnik E, et al (2020). Feasibility and safety of exercise training and nutritional support prior to haematopoietic stem cell transplantation in patients with haematologic malignancies. BMC Cancer. 20(1), 1142.
- Seguy D, et al. (2019). Better outcome of patients undergoing enteral tube feeding after myeloablative conditioning for allogeneic stem cell transplantation. Transplantation, 94(3), 287-94.
- Walrath M., et al. (2015). Gastrointestinal side effects and adequacy of enteral intake in hematopoietic stem cell transplant patients. Nutrition in Clinical Practice, 30(2), 305–310.
- Zama D, et al. (2021). Enteral versus Parenteral Nutrition as Nutritional Support after Allogeneic Hematopoietic Stem Cell Transplantation: a Systematic Review and Meta-Analysis. Transplantation and Cellular Therapy, 27(2), 180 e1- e8.




