Nutritional Assessment: een belangrijke en ingewikkelde puzzel op de Intensive Care
14 april 2023Belang van Nutritional Assessment bij ernstig zieke volwassen patiënten op de Intensive Care voor optimale zorg.
Auteurs: Patty Lakenman* , Wesley Visser*, Joanne Olieman*
* Afdeling Inwendige Geneeskunde, afdeling Dietetiek, Erasmus Medisch Centrum, Rotterdam, Nederland
Citeer als: Lakenman P, Visser W, Olieman J, Nutritional Assessment: een belangrijke en ingewikkelde puzzel op de Intensive Care, Voeding & Visie 2023(36) 1: 16-22
Samenvatting
Patiënten op de Intensive Care (IC) hebben risico op ontwikkeling van ziekte-gerelateerde ondervoeding door een complex en wisselend metabolisme wat de voedingstoestand over het verloop van tijd negatief beïnvloedt. Het doel van gepersonaliseerde voedingstherapie bij IC-patiënten is het zoveel mogelijk voorkomen van (progressieve) ondervoeding en het daarmee bevorderen van herstel. Nutritional Assessment (NA) is een kwantitatieve beoordeling van de vier domeinen van de voedingstoestand (nutriëntenbalans, lichaamssamenstelling, functionaliteit en biochemie) die hierbij wordt ingezet. Dit overzichtsartikel gaat over de inzet en het belang van NA op de IC voor optimale zorg. Bij de evaluatie van de nutriëntenbalans is het van belang om rekening te houden met calorieën uit medicatie en bij voorkeur het energieverbruik te meten met indirecte calorimetrie. Het gewicht (BMI) van patiënten op de IC zegt weinig over de voedingstoestand door o.a. vochtschommelingen. Daarom wordt bij voorkeur de lichaamssamenstelling gemeten in combinatie met de functionaliteit met beschikbare valide testen om de dieetbehandeling te kunnen optimaliseren. De biochemische status geeft inzicht in ziektestatus en lichaamsreserves aan voedingsstoffen en kan indicatief zijn voor het diagnosticeren van het type ondervoeding. Na de IC-opname blijken patiënten vaak maar 50% van hun berekende behoefte binnen te krijgen, daarom is het belangrijk om de voedingstoestand ook na (IC) opname te monitoren. Er bestaat nog geen eenduidige definitie om (acuut) kritiek ziektegerelateerde ondervoeding te bepalen, maar NA geeft essentiële informatie in de beoordeling van de voedingstoestand en is van meerwaarde om een adequaat voedingsadvies op- en bij te stellen ten gunste van het herstel van IC-patiënten.
Abstract
Nutritional Assessment: an important and complicated puzzle in the Intensive Care Unit
Patients in Intensive Care (ICU) are at risk of developing disease-related malnutrition due to a complex and fluctuating metabolism which negatively affects nutritional status over time. The goal of personalized nutritional support in ICU patients is to prevent (progressive) malnutrition as much as possible and thereby promote recovery. Nutritional Assessment (NA) is a quantitative assessment of the 4 domains of nutritional status (nutrient balance, body composition, functionality and biochemical status) that is used for this purpose. This article discusses the use and importance of NA in the ICU for optimal care. When evaluating the nutrient balance, it is important to take into account non- nutritional calories and preferably measure resting energy expenditure with indirect calorimetry. The weight (BMI) of patients in the ICU does not provide adequate information about nutritional status due to fluid fluctuation. Therefore, bodycomposition is preferably measured in combination with functional status using the available valid tests to optimize nutritional support. The biochemical status provides insight into diseasestatus and bodyreserves of nutrients and can be indicative for diagnosing type of malnutrition. After ICU discharge, patients often receive only 50% of their calculated nutritional requirements, so it is important to monitor nutritional status even after (ICU) admission. There is not yet an uniform definition to determine (acute) critical illness-related malnutrition, but NA provides essential information in the assessment of nutritional status and is of added value in determining adequate nutritional support to benefit the recovery of ICU patients.
Introductie
Ziek zijn zorgt voor een complex van hormonale en metabole veranderingen om te overleven. De intensiteit en duur van deze veranderingen hebben een negatief effect op de voedingstoestand van patiënten op de Intensive Care (IC) (McClave, 2016; Singer, 2019). Er bestaat momenteel nog geen definitie voor (acuut) kritiek ziektegerelateerde ondervoeding (Singer, 2019) en er is nog geen valide screeningstool om het risico op ondervoeding voor IC-patiënten te bepalen. Er wordt aangeraden om iedere patiënt die langer dan 48 uur op de IC opgenomen ligt te beschouwen als risicopatiënt op de ontwikkeling van ziektegerelateerde ondervoeding (Singer, 2019). Naar schatting is de prevalentie van ondervoeding op de IC 40-50% (Heyland, 2003, Dong 2021).
Er zijn drie verschillende metabole ziektefases tijdens IC-opname te onderscheiden met elk hun eigen kenmerken en impact op de voedingstoestand (Wischmeyer, 2018; Singer, 2019): 1) de acute fase, 2) de late/chronische fase en 3) de herstelfase. De acute fase kan tot circa 3-7 dagen na opname duren en kan worden opgesplitst in de acute vroege (1-2 dagen na opname) en de acute late fase (vanaf dag 3). Deze fase wordt gekenmerkt door metabole veranderingen, katabolie en spiermassa-afbraak. Vervolgens komt de patiënt in een late/chronische fase welke wordt gekenmerkt door afname van de inflammatie, afbouwen beademing en start mobilisatie. De herstelfase start na het verlaten van de IC. De respons van het lichaam op ernstige ziekte/stress verandert het metabolisme van diverse organen (o.a. lever en spier) met als doel de homeostase te herstellen, het bloedverlies te verminderen en de bloeddoorstroming te verbeteren, zodat de afgifte van voedingsstoffen en afvalproducten beter kan verlopen (Cresci, 2015). Aangezien het metabolisme onder invloed van ernstige ziekte voortdurend verandert, geven zowel onder- als overvoeden tijdens IC-opname een verhoogde kans op complicaties en overlijden (Singer, 2019). Om die reden is het belangrijk per metabole ziektefase de voedingsinname aan te passen (Wischmeyer, 2018; Wernerman, 2019).
Hoe voeden tijdens de metabole ziektefases?
De toediening van voeding dient geleidelijk opgebouwd te worden in de acute fase tijdens IC-opname. Tijdens de vroege acute fase kan de lever de voedingsstoffen vanuit de voeding niet adequaat verwerken. De opname van glucose is verminderd en de glycogeenreserve (spieren en lever) wordt binnen 24 uur verbruikt (Cresci, 2015). Daarnaast is de eiwitaanmaak in deze fase gericht op productie van acute-fase-eiwitten, die nodig zijn voor de immunologische respons op stress, en de afbraak van spiermassa is verhoogd tot 1 kg verlies per dag wat resulteert in een negatieve stikstofbalans (Cresci, 2015). Om de darmintegriteit (gezondheid van de darm) te behouden, is het advies om binnen 24-48 uur te starten met een kleine hoeveelheid enterale voeding tot 500 ml verdeeld over 24 uur. Vanaf de acute late fase (3-5 dagen na IC-opname) kan de voeding geleidelijk opgehoogd worden naar de individuele voedingsbehoefte (Singer, 2019). In de herstelfase is het streven om de voedingsinname/toestand zo optimaal mogelijk te houden conform de voedingsbehoefte in combinatie met mobilisatie.
Om een individueel adequaat voedingsadvies tijdens alle fases van ziekte en herstel op te stellen kan de diëtist gebruikmaken van nutritional assessment (NA) waarmee de voedingstoestand wordt gevolgd. Hiermee kan essentiële informatie worden verzameld die helpt om de ingewikkelde puzzel van de optimale dieetbehandeling voor IC-patiënten op te lossen.
Nutritional Assessment (NA) op de IC
Een gestructureerd NA is aanbevolen om een evidence-based dieetadvies op- en bijstellen (Gibson, 2005). De voedingstoestand van ernstig zieke patiënten kan geëvalueerd worden aan de hand van de vier verschillende domeinen van NA: 1) de nutriëntenbalans, 2) de lichaamssamenstelling, 3) de functionaliteit en 4) de biochemie.
Domein 1: Nutriëntenbalans
De nutriëntenbalans is het resultaat van de voedingsinname versus de voedingsbehoefte en de voedingsverliezen.
Voedingsinname
De meeste IC-patiënten zijn niet in staat om zelf te eten vanwege de beademing en medicatie, en worden over het algemeen gevoed met sondevoeding (Singer, 2019). Indien sondevoeding niet goed verdragen wordt of niet gegeven kan worden, zoals bij darmobstructies, kan gekozen worden voor parenterale voeding (Singer, 2019). Een veranderde motiliteit van het maag-darmkanaal is de voornaamste reden waarom volledige enterale voeding niet lukt (Cresci, 2015). Naast de voeding levert ook bepaalde medicatie, zoals propofol (=een vetoplossing) en glucose/dextrose, calorieën en het is belangrijk deze mee te nemen met de berekening van de voedingsinname om overvoeding te voorkomen (Singer, 2019). Het gebruik van citraat bij patiënten aan gekoppeld zijn aan de continue dialyse (CVVH) is ook een extra energiebron, maar de exacte calorische inname is in de praktijk lastig te bepalen, omdat die afhangt van factoren zoals de inloopsnelheid en concentratie (Bousie, 2016). In de praktijk worden propofol en glucose/dextrose meestal meegerekend als energiebron, maar voor citraat is dit afhankelijk van het ziekenhuisprotocol.
In een internationale multicenter studie bij een algemene IC-populatie (medisch-chirurgisch en neurologische patiënten) is aangetoond dat de gemiddelde voedingsinname rond 50-60% van de geschatte voedingsbehoefte ligt gedurende de eerste 7-10 dagen van IC-opname (Heyland, 2015; Javid, 2021). Echter, werden in deze studies niet altijd de calorieën uit medicatie meegenomen en waren er grote verschillen per land/groep. In onze studie bij een groep Nederlandse patiënten met COVID-19 hebben wij geobserveerd dat de meeste patiënten (55-66% op dag 4 en 80-83% op dag 10-14) adequaat enteraal gevoed (>80% van de gemeten behoefte) werden tijdens IC-opname (Lakenman, 2022).
Voedingsbehoefte- energie
Studies laten zien dat de energiebehoefte van IC-patiënten niet goed in te schatten is, omdat voorspellende formules ten hoogste 50% nauwkeurigheid van de werkelijke behoefte weergeven (Zusman, 2019). Het meten van het energieverbruik met behulp van de indirecte calorimetrie wordt gezien als de gouden standaard om de energiebehoefte van IC-patiënten te bepalen (Singer, 2019). Uit onderzoek blijkt, dat voeden op basis van deze meting de kans op overlijden van IC-patiënten op korte termijn verkleint (Duan, 2021; Pertzov, 2022). De meerwaarde van deze techniek op klinische (langere termijn) uitkomsten is nog niet bewezen in gerandomiseerde studies, maar de indirecte calorimetrie heeft potentie om de voedingstoestand te verbeteren tijdens de fase van ziekte en herstel. (Singer, 2019; Moonen, 2021).
Tijdens deze energiemeting wordt de zuurstofopname (VO2) en koolstofdioxide uitgifte (VCO2) gemeten. Aan de hand van deze waarden kan het energieverbruik (kCal) berekend worden m.b.v. de formule van Weir (Weir, 1949). Daarnaast wordt de verhouding tussen de VCO2 en VO2 gemeten (respiratoir quotiënt (RQ)). Dit is een indicator van het verbruikte (voedings)substraat door de patiënt tijdens de meting, waarbij 1.0 overeenkomt met oxidatie van glucose, 0.8 met eiwitoxidatie en 0.7 met vetoxidatie. Normaal gesproken ligt de RQ binnen de fysiologische range van 0.67-1.3 en kan een afwijkende waarde ook gebruikt worden als indicator voor de betrouwbaarheid van de meting (McClave, 2003; Achamrah, 2021).
Het energieverbruik wordt o.a. beïnvloed door pathofysiologische factoren, zoals koorts (verhogend) en (verslappende)medicatie (verlagend) (Moonen, 2021). Tijdens de meting is het belangrijk om deze factoren te inventariseren, omdat deze van invloed kunnen zijn op interpretatie van de resultaten. Het is raadzaam om de indirecte calorimetrie vanaf dag 3-4 na opname te doen en tenminste wekelijks te herhalen (Singer, 2019; Moonen, 2021) vanwege fluctuaties in het energieverbruik tijdens opname (Rattanachaiwong, 2019), tenzij eerder geïndiceerd bij klinische veranderingen die van invloed kunnen zijn op het energieverbruik. Het gemeten energieverbruik kan zowel (fors) lager als hoger uitvallen ten opzichte van de schatting met behulp van de voorspellende formules, zoals WHO formule (Food and Agricutural Organization, 2001) in geval van een BMI <30 kg/m2 of Harris and Benedict (Harris, 1919) bij een BMI >30 kg/m2 volgens het stroomschema van het Nutritional Assessment Platform (NAP, 2021) met eventuele toeslagen, en kan per patiënt tijdens opname flink fluctueren. Sinds we het energieverbruik meten, zijn we beter in staat om onder- en overvoeden zoveel mogelijk te voorkomen en is onze praktijkervaring dat patiënten eerder van de beademing afkomen.
Indien er geen indirecte calorimetrie beschikbaar is, kan als alternatief de gemeten VCO2 waarden van het beademingsapparaat x 8.19 gebruikt worden (Stapel, 2016), maar deze methode is minder betrouwbaar dan de indirecte calorimetrie (Singer, 2019). Indien VCO2 waarden niet beschikbaar zijn kunnen voorspellende formules worden ingezet of de richtlijn 12-25 kcal/kg lichaamsgewicht voor het bepalen van de energiebehoefte (Compher, 2022). Er bestaat niet één formule die het beste is en het blijft een (lastige) schatting. Het advies is om in de eerste week van IC-opname in elk geval hypocalorisch te voeden (ca. 70% van de geschatte energiebehoefte) om overvoeding te voorkomen (Singer, 2019). Het bepalen van de juiste energiebehoefte is een lastige en complexe puzzel waarbij het meten van het energieverbruik van meerwaarde is om dit puzzelstukje goed te kunnen leggen.
Voedingsbehoefte- eiwit
Ernstig zieke patiënten bevinden zich in een katabole toestand waardoor de eiwitbehoefte hoger ligt om het spiermassaverlies zoveel mogelijk tegen te gaan (Ishibashi, 1998). Met behulp van de stikstofbalans (eiwitinname versus het eiwitverlies in o.a. urine en ontlasting) kan de eiwitbehoefte nauwkeurig bepaald worden (Joint and World Health, 1985), maar in de praktijk wordt de behoefte vaak op basis van het lichaamsgewicht vastgesteld. Bij patiënten zonder obesitas wordt in de huidige richtlijnen aangeraden om minimaal 1,3 g/kg lichaamsgewicht/dag aan te houden als eiwitbehoefte ter bevordering van overleving/herstel (Singer, 2019). In de praktijk wordt vaak een hogere behoefte van >1,5 gram/kg lichaamsgewicht/dag eiwit als doel aangehouden, omdat het lastig blijkt om minimaal 1,3 gram/kg lichaamsgewicht/dag te halen (Alberda, 2009; Heyland, 2017). Bij obese patiënten (BMI >30 kg/m2) op de IC wordt geadviseerd om de eiwitbehoefte op basis van stikstofverlies in de urine te baseren en niet op basis van lichaamsgewicht. De lichaamssamenstelling van deze patiënten kan namelijk afwijkend zijn (hoge vetmassa en lage spiermassa, of hoge vetmassa en hoge spiermassa). In de praktijk is het lastig haalbaar om dit op een betrouwbare manier structureel te bepalen (Singer, 2019). Als alternatief zou gerekend kunnen worden met het (gecorrigeerde) ideale lichaamsgewicht bij BMI van 25 kg/m2 (Singer, 2019) of kan bij patiënten met overgewicht (BMI >27,5 kg/m2) en obesitas de vetvrije massa gemeten of geschat worden m.b.v. Gallagher formule x 1,9 om de eiwitbehoefte te bepalen (Gallagher, 2000).
Er is onvoldoende bewijs dat meer eiwitten geven gunstiger is voor het herstel van IC-patiënten (Singer, 2019), maar het is wel bekend dat te weinig eiwit geven geassocieerd is met hogere kans op mortaliteit (Zusman, 2016). Er zijn momenteel nog geen richtlijnen die aanraden om eiwitbehoefte te bepalen op basis van gemeten vetvrije- of spiermassa. Recent onderzoek bij COVID-19 patiënten raadt wel aan om dit te doen om een te lage eiwitdosering te voorkomen (Moonen, 2022). Vanwege de variërende lichaamssamenstelling per patiënt (zie domein 2) wordt er in het Erasmus Medisch Centrum naar gestreefd om de eiwitbehoefte te bepalen op basis van gemeten vetvrije massa (x 1,9) met de BIA, zo nodig gecorrigeerd voor vochtretentie op basis van de extracellulair water/totaal lichaamswater ratio (Moonen, 2020). Indien dit niet lukt, wordt minimaal 1,5 gram/kg lichaamsgewicht/d aangehouden bij BMI <27,5 kg/m2 en bij een BMI ≥27,5 kg/m2 wordt de vetvrije massa met behulp van de Gallagher formule geschat en de eiwitbehoefte bepaald door de geschatte vet vrije massa* minimaal 1,9 (Velzeboer, 2017). Per casus wordt beoordeeld of extra eiwitten nodig zijn in geval van bijvoorbeeld brandwonden of verhoogde eiwitverliezen in de urine (zie paragraaf Voedingsverliezen). Een eiwitbeperking is in de meeste gevallen niet nodig bij een verminderde nierfunctie (Singer, 2019; Fiaccadori, 2021), tenzij er sprake is van metabole ziekte(n) (Kazmierczak, 1993; Machado, 2014). Momenteel is er nog weinig bekend over de beste timing (Arabi, 2017) en het type eiwit dat zou moeten worden gegeven aan IC-patiënten.
Voedingsverliezen
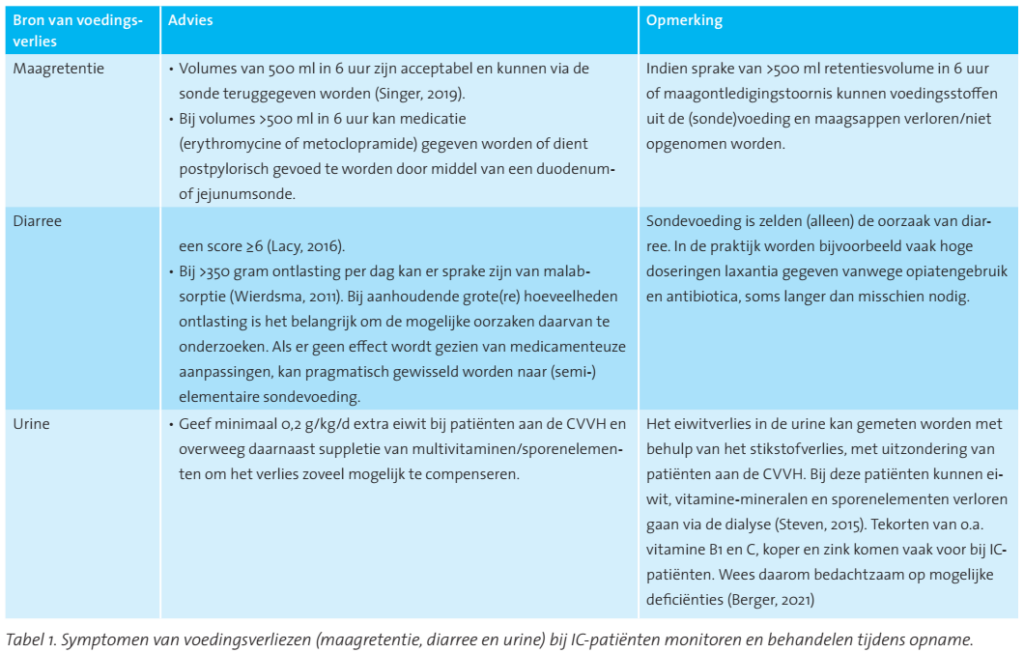
Het is belangrijk de voedingsverliezen te bepalen om een idee te hebben van de beschikbaarheid van voedingsstoffen in het lichaam. Hoge voedingsverliezen kunnen duiden op voedingsintolerantie en het is essentieel om rekening te houden met eventuele voedingsverliezen. Er bestaat nog geen eenduidige definitie voor voedingstolerantie bij IC-patiënten, maar er wordt wel aangeraden om symptomen zoals maagretentie en ontlasting tijdens IC-opname te monitoren (Reintam Blaser, 2021). De voedingsverliezen kunnen bepaald worden in maagretentie, gal, chylus, ascites, urine (dialyse) en ontlasting bij IC-patiënten (van Schijndel, 2006). In tabel 1 staat vermeld hoe deze verliezen (maagretentie, diarree en urine) te monitoren tijdens opname.
Domein 2: Lichaamssamenstelling
Het lichaam bestaat uit orgaan-, spier-, vet- en botmassa en vocht. Het gedeelte zonder vetweefsel, de vetvrije massa, bestaat voornamelijk uit spier- en orgaanweefsel. Dit is het belangrijkste lichaamsgedeelte, omdat dit (eiwitrijke)deel gebruikt kan worden bij het opbouwen van een immuunrespons of het herstellen van weefsel (Earthman, 2017). Gewichtsveranderingen bij IC-patiënten zijn moeilijk te interpreteren door vochtschommelingen en weerspiegelen daarom geen veranderingen in de lichaamssamenstelling (Singer, 2019). Zoals eerder beschreven kan er tot 1 kg spiermassa per dag verloren gaan tijdens IC-opname, wat geassocieerd is met meer complicaties, mortaliteit en een langere ziekenhuisopname (Singer, 2019).
De lichaamssamenstelling kan gemeten worden met methoden die vet van vetvrije massa kunnen onderscheiden en vooral de specifieke onderdelen van de vetvrije massa (skeletspiermassa, lichaamscelmassa, intracellulair en extracellulair water). Hiervoor kunnen diverse technieken gebruikt worden, zoals spierechografie, bio-elektrische impedantie analyse (BIA) en CT-scans (Singer, 2019). Momenteel is er nog geen specifieke voorkeur voor een bepaalde techniek om de lichaamssamenstelling te bepalen (Smith, 2022). De BIA is de meest gebruikte techniek in de reguliere zorg (Smith, 2022) en kan op basis van impedantie (reactance en resistance) de totale (en segmentale) vet en vetvrije massa en vochtstatus meten. Contra-indicaties om de BIA te gebruiken op de IC zijn bijvoorbeeld een pacemaker of MRSA-isolatie. In de reguliere zorg op de IC wordt nog weinig gebruik gemaakt van de BIA om de lichaamssamenstelling te meten. Enerzijds vanwege kosten- en tijdsoverwegingen, anderzijds omdat oudere BIA- apparaten niet in staat waren om het vocht te onderscheiden van vetvrije massa. Dit is een vereiste voor IC-patiënten vanwege de vochtschommelingen. Momenteel kunnen steeds meer BIA-apparaten dit wel en zijn daarmee geschikt voor IC-patiënten (Kuchnia, 2017).
In een recente studie zagen wij in een groep COVID-19 patiënten het lichaamsgewicht tijdens IC-opname tussen dag 4 en 10 na opname afnemen met 3 kg, waarvan 6 kg verlies aan vetvrije massa en toename van 3 kg vetmassa gemeten met BIA (Lakenman,2023). Bij het gewichtsverlies van IC-patiënten kan de lichaamssamenstelling dus (ongunstig) veranderen. Het is belangrijk om deze veranderingen te monitoren en zo nodig het dieetadvies hierop af te stemmen. Interventiestudies zijn gaande om de invloed van voeding- en mobilisatie op het behoud van spiermassa op de IC te onderzoeken. Het gewicht (BMI) van IC-patiënten zegt weinig over de voedingstoestand en het meten van de lichaamssamenstelling is daarom een belangrijk puzzelstukje om de voedingstoestand goed te kunnen beoordelen.
Domein 3: Functionele status
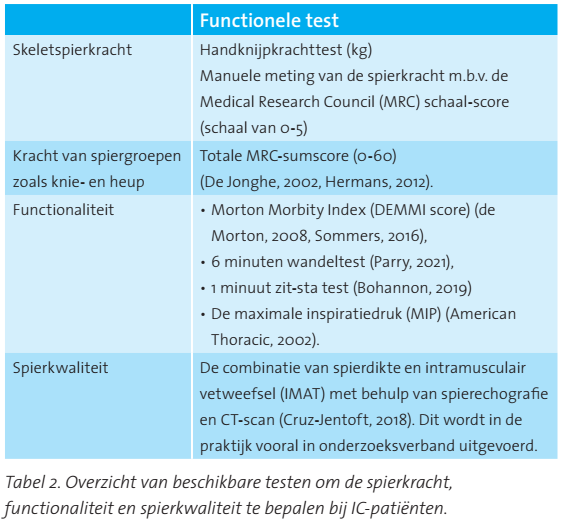
De functionele status is gerelateerd aan de lichaamssamenstelling (Gibson, 2005). De functionele status en spierkracht worden gezien als indirecte parameters van (verandering in) voedingstoestand en zijn daarom relevante klinische eindpunten van voedingsinterventies tijdens en na IC-opname. Naast veranderingen in de spiermassa spelen ook factoren zoals spierkwaliteit en spiersamenstelling, een rol bij de afname van de spierfunctie tijdens en na ernstige ziekte (Correa-de-Araujo, 2017). Er zijn verschillende testen beschikbaar om de spierkracht, functionaliteit en spierkwaliteit te bepalen (zie tabel 2).
Er is aangetoond dat 60-80% van de overlevenden IC-patiënten 12-18 maanden na ontslag nog steeds functioneel beperkt is (Wischmeyer, 2015). Een verminderde spierkracht tijdens IC-opname is een onafhankelijke voorspeller van overleving en wordt in verband gebracht met op IC-gerelateerde zwakte (ICU-AQW) (Looijaard, 2018). Wanneer de resultaten van de functionele testen worden vergeleken met de referentiewaarden geeft dit de functionaliteit weer van de patiënten. Deze testen zijn vaak mogelijk zodra een patiënt zich in de (acute) late fase bevindt en kunnen uitgevoerd worden door fysiotherapeuten op de IC.
Het uitbreiden van mobiliseren/verbeterde functionaliteit dient meegenomen te worden als puzzelstukje in de beoordeling van de voedingstoestand en zo nodig kan de voedingsbehoefte hierop aangepast te worden door extra energie en eiwit te geven.
Domein 4: Biochemische status
De biochemische status wordt gebruikt om de ziektestatus en lichaamsreserves aan voedingsstoffen in te schatten. Een aantal belangrijke aandachtspunten hierbij zijn:
• Het dagelijks monitoren van natrium, kalium, magnesium en fosfaat
Tijdens de acute fase zijn er vaak tekorten aan magnesium en fosfaat door veranderingen in het koolhydraatmetabolisme in relatie tot insulinerespons. Tevens kunnen er veranderingen in het serum natrium en kalium optreden tijdens IC-opname als gevolg van veranderingen in celmembraanpermeabiliteit, spiermassa-afbraak en toediening van intraveneuze vloeistoffen om het circulerend volume te herstellen (leerboek). Om eventuele verliezen te voorkomen kan tijdens de acute fase pragmatisch gestart worden met een standaard multivitaminen en sporenelementen supplement totdat de patiënt volledig gevoed wordt, hier bestaan echter nog geen richtlijnen voor.
• Aandacht voor anti-oxidatieve micronutriënten
Door ernstige ziekte dalen anti-oxidatieve micronutriënten (vooral koper, selenium, zink, vitamines E en C) onder de normaalwaarden. Er is echter geen bewijs dat hoge doseringen antioxidanten als monotherapie gesuppleerd dienen te worden zonder bewezen deficiëntie (Singer, 2019).
• Aandacht voor vitamine D.
Dit is belangrijk, omdat er vaak lage vitamine D plasmawaardes voorkomen bij IC-patiënten.
Bij een bewezen deficiëntie (25-hydroxy-vitamine D <12,5 ng/ml, of 50 nmol/l) kan vitamine D3 (500.000 IU) in enkele doses gesuppleerd worden binnen 1 week na opname (Singer, 2019).
• Wees alert op het refeeding syndroom bij risicopatiënten
Hierbij gaat het met name om patiënten met lage inname/en of ongewenst (fors) gewichtsverlies en patiënten met verlies van nutriënten/verminderde absorptie. Bouw zo nodig voeding op in combinatie met vitaminesuppletie opgeleide van het refeedinglab volgens het protocol van het Nederlands Voedingsteam Overleg (2019) en de ESPEN guideline (Singer, 2019).
• Triglyceriden monitoren
Bij patiënten met (langdurig) propofol en/of TPV is het belangrijk om naast de leverwaarden ook minimaal 2x p/w de triglyceriden te monitoren en zo nodig pas de medicatie/voeding aan te passen.
• C-reactief proteïne (CRP) en leukocyten monitoren
Waarden zoals C-reactief proteïne (CRP) en leukocyten kunnen indicatief zijn voor ontsteking en sepsis (Woodworth, 2019) en zijn dit belangrijke markers voor de diagnose van (eventueel) het type ondervoeding. Het monitoren van deze waarden kunnen daarnaast inzicht geven in de ziektefase van de patiënt.
Afwijkende metingen zoals bloedglucose, elektrolyten, levertests, triglyceriden, ureum en sporenelementen zijn geassocieerd met een slechte uitkomst bij IC-patiënten (Berger, 2019).

Na de IC-opname
De IC-opname is een onderdeel van het herstelproces en het is belangrijk om de voedingstoestand na ontslag te blijven monitoren. Na de IC-opname hebben patiënten vaak een (nog) verhoogde eiwit- en energiebehoefte vanwege de revalidatie, echter blijkt uit onderzoek dat maar circa 50% van de patiënten hun berekende behoefte haalt. (Ridley, 2019). Dietistische begeleiding na ontslag van het ziekenhuis is helaas nog niet standaard in Nederland. Het zou wenselijk zijn om patiënten met een inadequate voedingsinname voor ontslag adviezen voor thuis mee te geven en zo nodig een eerstelijns diëtist te betrekken. Er is momenteel meer onderzoek gaande om inzicht te krijgen in de voedingstoestand en mogelijke dieetinterventies na de IC-opname.
Discussie en conclusie
In dit artikel onderbouwen we dat het uitvoeren van NA, waaronder het meten van het energieverbruik, de lichaamssamenstelling, de functionaliteit en het monitoren van biochemische waarden, een meerwaarde is om de voedingstoestand te beoordelen en om een individueel en adequaat voedingsadvies op- en bij te stellen voor IC patiënten ter bevordering van het herstel.
Naar schatting is 40-50% van de IC-patiënten in een slechte voedingstoestand/ondervoed (Heyland, 2003; Dong, 2021). Zoals eerder beschreven bestaat er momenteel nog geen eenduidige definitie om (acuut) kritiek ziektegerelateerde ondervoeding te bepalen. Er zijn verschillende methodes beschikbaar om de voedingstoestand in te schatten, zoals de Nutritional Risk Score (NRS), de NUTRIC-score en de Global Leadership Initiative on Malnutrition (GLIM) criteria, maar deze zijn (nog) niet geschikt voor IC-patiënten (Dong, 2021). Op basis van een recente studie lijken de GLIM-criteria acceptabel voor de IC (Theilla, 2021), maar verder onderzoek is nodig. De meest gebruikte methode om de voedingstoestand te bepalen in onderzoekverband is momenteel NUTRIC-score (Smith, 2022). Verder onderzoek naar een eenduidige definitie voor ondervoeding op de IC is wenselijk voor inzicht in de exacte prevalentie en om tijdig de juiste dieetbehandeling, inclusief NA, in te kunnen zetten.
Er wordt momenteel steeds meer onderzoek gedaan naar NA op de IC, maar meestal wordt per studie (observationeel) gekeken naar een specifiek domein van NA.Tevens zijn er nog weinig studies uitgevoerd over het natuurlijk beloop van de NA-domeinen na de (IC) opname. Er zijn momenteel diverse studies gaande naar de voedingstoestand na IC-opname. Meer inzicht in complete NA tijdens en na (IC) opname is belangrijk om voedingstherapie (verder) te optimaliseren ten gunste van het herstel van patiënten. Daarom zijn meer interventiestudies nodig die het effect van gecombineerde voedings-en mobilisatie onderzoeken op het herstel/behoud van voedingstoestand op lange termijn.
Om het uitvoeren van NA op de IC in de dagelijkse praktijk makkelijker te maken, zou het wenselijk zijn om apparaten die het energieverbruik en lichaamssamenstelling kunnen meten te koppelen of deze functies in één apparaat samen te voegen dat gebruiksvriendelijk is voor meerdere disciplines. Een ideaal tijdstip om dan een meting uit te voeren zou in de avond/nacht zijn als de patiënt zoveel mogelijk in rust is. In het optimale scenario worden de uitslagen/gegevens meteen uit het apparaat gekoppeld aan het elektronisch patiëntendossier en een (onderzoeks)database. Op deze manier kunnen gegevens efficiënter verzameld en verwerkt worden en levert dit meer wetenschappelijke inzichten op om de voedingstherapie te kunnen optimaliseren.
Concluderend levert NA essentiële informatie over de vier domeinen om de ingewikkelde puzzel voor de juiste voedingstherapie op te lossen. NA wordt steeds meer toegepast op de IC, maar het behouden van een acceptabele voedingstoestand tijdens opname blijft een uitdaging. Tevens is er nog (te) weinig bekend over het verloop van de voedingstoestand na ontslag van het ziekenhuis. Meer onderzoek naar voeding- en mobilisatie-interventies tijdens en na IC-opname op behoud/herstel van voedingstoestand is belangrijk om de puzzel naar de optimale dieetbehandeling, en daarmee beter herstel, verder te kunnen oplossen.
Referenties
(2019). NVO Richtlijn Refeedingsyndroom.
Achamrah, N., M. Delsoglio, E. De Waele, M. M. Berger and C. Pichard (2021). “Indirect calorimetry: The 6 main issues.” Clinical Nutrition 40(1): 4-14.
Alberda, C., L. Gramlich, N. Jones, K. Jeejeebhoy, A. G. Day, R. Dhaliwal and D. K. Heyland (2009). “The relationship between nutritional intake and clinical outcomes in critically ill patients: results of an international multicenter observational study.” Intensive Care Medicine 35(10): 1728-1737.
American Thoracic, S. (2002). “ATS/ERS Statement on respiratory muscle testing.” Am J Respir Crit Care Med 166: 518-624.
Arabi, Y. M., M. P. Casaer, M. Chapman, D. K. Heyland, C. Ichai, P. E. Marik, R. G. Martindale, S. A. McClave, J.-C. Preiser and J. Reignier (2017). “The intensive care medicine research agenda in nutrition and metabolism.” Intensive care medicine 43(9): 1239-1256.
Berger, M. M., A. Reintam-Blaser, P. C. Calder, M. Casaer, M. J. Hiesmayr, K. Mayer, J. C. Montejo, C. Pichard, J.-C. Preiser and A. R. H. Van Zanten (2019). “Monitoring nutrition in the ICU.” Clinical nutrition 38(2): 584-593.
Berger MM, Broman M, Forni L, Ostermann M, De Waele E, Wischmeyer PE. Nutrients and micronutrients at risk during renal replacement therapy: a scoping review. Current opinion in critical care. 2021;27(4):367.
Bohannon, R. W. and R. Crouch (2019). “1-Minute sit-to-stand test: systematic review of procedures, performance, and clinimetric properties.” Journal of cardiopulmonary rehabilitation and prevention 39(1): 2-8.
Bousie, E., D. Van Blokland, H. J. W. Lammers and A. R. H. van Zanten (2016). “Relevance of non-nutritional calories in mechanically ventilated critically ill patients.” European journal of clinical nutrition 70(12): 1443-1450.
Compher, C., A. L. Bingham, M. McCall, J. Patel, T. W. Rice, C. Braunschweig and L. McKeever (2022). “Guidelines for the provision of nutrition support therapy in the adult critically ill patient: The American Society for Parenteral and Enteral Nutrition.” Journal of Parenteral and Enteral Nutrition 46(1): 12-41.
Correa-de-Araujo, R., M. O. Harris-Love, I. Miljkovic, M. S. Fragala, B. W. Anthony and T. M. Manini (2017). “The need for standardized assessment of muscle quality in skeletal muscle function deficit and other aging-related muscle dysfunctions: A symposium report.” Frontiers in physiology 8: 87.
Cresci PhD, G. A. (2015). Nutrition Support for the Critically Ill Patient: A Guide to Practice, Second Edition (2nd ed.). CRC Press.
Cruz-Jentoft, A. J., G. Bahat, J. Bauer, Y. Boirie, O. Bruyère, T. Cederholm, C. Cooper, F. Landi, Y. Rolland and A. A. Sayer (2018). “Sarcopenia: revised European consensus on definition and diagnosis.” Age and ageing 48(1): 16-31.
De Jonghe, B., T. Sharshar, J.-P. Lefaucheur, F.-J. Authier, I. Durand-Zaleski, M. Boussarsar, C. Cerf, E. Renaud, F. Mesrati and J. Carlet (2002). “Paresis acquired in the intensive care unit: a prospective multicenter study.” Jama 288(22): 2859-2867.
de Morton, N. A., M. Davidson and J. L. Keating (2008). “The de Morton Mobility Index (DEMMI): an essential health index for an ageing world.” Health and quality of life outcomes 6(1): 1-15.
Dong, V. and C. J. Karvellas (2021). “Using technology to assess nutritional status and optimize nutrition therapy in critically ill patients.” Current Opinion in Clinical Nutrition & Metabolic Care 24(2): 189-194.
Duan, J.-Y., W.-H. Zheng, H. Zhou, Y. Xu and H.-B. Huang (2021). “Energy delivery guided by indirect calorimetry in critically ill patients: a systematic review and meta-analysis.” Critical Care 25(1): 1-10.
Earthman, C. P., R. R. Wolfe and S. B. Heymsfield (2017). “Dudrick Research Symposium 2015—lean tissue and protein in health and disease: Key targets and assessment strategies.” Journal of Parenteral and Enteral Nutrition 41(2): 226-237.
Fah M, Van Althuis LE, Ohnuma T, Winthrop HM, Haines KL, Williams DGA, et al. Micronutrient Deficiencies in Critically Ill Patients Receiving Continuous Renal Replacement Therapy. Clinical Nutrition ESPEN. 2022.
Fiaccadori, E., A. Sabatino, R. Barazzoni, J. J. Carrero, A. Cupisti, E. De Waele, J. Jonckheer, P. Singer and C. Cuerda (2021). “ESPEN guideline on clinical nutrition in hospitalized patients with acute or chronic kidney disease.” Clinical Nutrition 40(4): 1644-1668.
Food and Agricutural Organization. Human energy requirements: Report of a Joint FAO/WHO/UNU Expert Consultation. FAO Food Nutr Tech Rep Ser [Internet]. 2001;0:96. Available from: ftp://ftp.fao.org/docrep/fao/007/y5686e/ y5686e00.pdf.
Gallagher, D., S. B. Heymsfield, M. Heo, S. A. Jebb, P. R. Murgatroyd and Y. Sakamoto (2000). “Healthy percentage body fat ranges: an approach for developing guidelines based on body mass index.” The American journal of clinical nutrition 72(3): 694-701.
Gibson, R. S. (2005). Principles of nutritional assessment, Oxford university press, USA.
Harris JA, Benedict FG. A Biometric Study of Human Basal Metabolism. Proc Natl Acad Sci U S A. 1918;4(12):370–3.
Hermans, G., B. Clerckx, T. Vanhullebusch, J. Segers, G. Vanpee, C. Robbeets, M. P. Casaer, P. Wouters, R. Gosselink and G. Van Den Berghe (2012). “Interobserver agreement of Medical Research Council sum-score and handgrip strength in the intensive care unit.” Muscle & nerve 45(1): 18-25.
Heyland, D. K., R. Dhaliwal, J. W. Drover, L. Gramlich and P. Dodek (2003). “Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients.” Journal of Parenteral and Enteral nutrition 27(5): 355-373.
Heyland, D. K., R. Dhaliwal, M. Wang and A. G. Day (2015). “The prevalence of iatrogenic underfeeding in the nutritionally ‘at-risk’critically ill patient: Results of an international, multicenter, prospective study.” Clinical Nutrition 34(4): 659-666.
Heyland, D. K., P. J. M. Weijs, J. A. Coss-Bu, B. Taylor, A. S. Kristof, G. E. O’Keefe and R. G. Martindale (2017). “Protein delivery in the intensive care unit: optimal or suboptimal?” Nutrition in Clinical Practice 32: 58S-71S.
Ishibashi, N., L. D. Plank, K. Sando and G. L. Hill (1998). “Optimal protein requirements during the first 2 weeks after the onset of critical illness.” Critical care medicine 26(9): 1529-1535.
Javid, Z., M. Shadnoush, M. Khadem-Rezaiyan, N. M. Z. Honarvar, A. Sedaghat, S. M. Hashemian, S. H. Ardehali, M. Nematy, O. Pournik and M. T. Beigmohammadi (2021). “Nutritional adequacy in critically ill patients: Result of PNSI study.” Clinical Nutrition 40(2): 511-517.
Joint, F. A. O. and O. World Health (1985). Energy and protein requirements: report of a Joint FAO/WHO/UNU Expert Consultation [held in Rome from 5 to 17 October 1981], World Health Organization.
Kazmierczak, S. C. (1993). “Diseases of metabolism (disorders of amino acid metabolism).” Analytical chemistry 65(12): 401-404.
Kuchnia, A., C. Earthman, L. Teigen, A. Cole, M. Mourtzakis, M. Paris, W. Looijaard, P. Weijs, H. Oudemans-van Straaten and G. Beilman (2017). “Evaluation of bioelectrical impedance analysis in critically ill patients: results of a multicenter prospective study.” Journal of Parenteral and Enteral Nutrition 41(7): 1131-1138.
Lacy, B. E., F. Mearin, L. Chang, W. D. Chey, A. J. Lembo, M. Simren and R. Spiller (2016). “Bowel disorders.” Gastroenterology 150(6): 1393-1407. e1395.
Lakenman, P. L. M., J. C. van Schie, B. van der Hoven, S. J. Baart, R. D. Eveleens, J. van Bommel, J. F. Olieman and K. F. M. Joosten “Nutritional intake and gastro-intestinal symptoms in critically ill COVID-19 patients.” Clinical Nutrition in press.
Lalanne, J. (2008). Fiscal Fitness: 8 Steps to Wealth & Health from America’s Leaders of Fitness and Finance: Easyread Super Large 20pt Edition, ReadHowYouWant. com.
Looijaard, W. G. P. M., J. Molinger and P. J. M. Weijs (2018). “Measuring and monitoring lean body mass in critical illness.” Current opinion in critical care 24(4): 241.
Machado, M. C. and F. P. da Silva (2014). “Hyperammonemia due to urea cycle disorders: a potentially fatal condition in the intensive care setting.” Journal of intensive care 2(1): 1-5.
McClave, S. A., C. C. Lowen, M. J. Kleber, J. W. McConnell, L. Y. Jung and L. J. Goldsmith (2003). “Clinical use of the respiratory quotient obtained from indirect calorimetry.” Journal of Parenteral and Enteral Nutrition 27(1): 21-26.
McClave, S. A., B. E. Taylor, R. G. Martindale, M. M. Warren, D. R. Johnson, C. Braunschweig, M. S. McCarthy, E. Davanos, T. W. Rice and G. A. Cresci (2016). “Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN).” JPEN. Journal of parenteral and enteral nutrition 40(2): 159-211.
Moonen HPFX, van Zanten FJL, Driessen L, de Smet V, Slingerland-Boot R, Mensink M, et al. Association of bioelectric impedance analysis body composition and disease severity in COVID-19 hospital ward and ICU patients: The BIAC-19 study. Clinical Nutrition. 2020.
Moonen, H. P. F. X., K. J. H. Beckers and A. R. H. van Zanten (2021). “Energy expenditure and indirect calorimetry in critical illness and convalescence: current evidence and practical considerations.” Journal of Intensive Care 9(1): 1-13.
Moonen, H. P. F. X., A. J. H. Hermans, I. Jans and A. R. H. van Zanten (2022). “Protein requirements and provision in hospitalised COVID-19 ward and ICU patients: Agreement between calculations based on body weight and height, and measured bioimpedance lean body mass.” Clinical nutrition ESPEN.
NAP. Stroomschema-voedselverbruik-NAP-augustus-2021-4.pdf (nutritionalassessment.nl)
Parry, S. M., S. R. Nalamalapu, K. Nunna, A. Rabiee, L. A. Friedman, E. Colantuoni, D. M. Needham and V. D. Dinglas (2021). “Six-minute walk distance after critical illness: a systematic review and meta-analysis.” Journal of intensive care medicine 36(3): 343-351.
Pertzov, B., H. Bar-Yoseph, Y. Menndel, I. Bendavid, I. Kagan, Y. D. Glass and P. Singer (2022). “The effect of indirect calorimetry guided isocaloric nutrition on mortality in critically ill patients—a systematic review and meta-analysis.” European Journal of Clinical Nutrition 76(1): 5-15.
Rattanachaiwong, S. and P. Singer (2019). “Indirect calorimetry as point of care testing.” Clinical Nutrition 38(6): 2531-2544.
Reintam Blaser, A., A. M. Deane, J. C. Preiser, Y. M. Arabi and S. M. Jakob (2021). “Enteral Feeding Intolerance: Updates in Definitions and Pathophysiology.” Nutrition in clinical practice 36(1): 40-49.
Ridley, E. J., R. L. Parke, A. R. Davies, M. Bailey, C. Hodgson, A. M. Deane, S. McGuinness and D. J. Cooper (2019). “What Happens to Nutrition Intake in the Post–Intensive Care Unit Hospitalization Period? An Observational Cohort Study in Critically Ill Adults.” Journal of Parenteral and Enteral Nutrition 43(1): 88-95.
Singer, P., A. R. Blaser, M. M. Berger, W. Alhazzani, P. C. Calder, M. P. Casaer, M. Hiesmayr, K. Mayer, J. C. Montejo and C. Pichard (2019). “ESPEN guideline on clinical nutrition in the intensive care unit.” Clinical nutrition 38(1): 48-79.
Smith, L. O., J. F. Olieman, K. A. Berk, G. C. Ligthart-Melis and C. P. Earthman (2022). “Clinical Applications of Body Composition and Functional Status Tools for Nutritional Assessment of Hospitalized Adults: A Systematic Review.” Journal of Parenteral and Enteral Nutrition.
Sommers, J., T. Vredeveld, R. Lindeboom, F. Nollet, R. H. H. Engelbert and M. van der Schaaf (2016). “de Morton mobility index is feasible, reliable, and valid in patients with critical illness.” Physical Therapy 96(10): 1658-1666.
Stapel, S. N., H.-J. S. de Grooth, H. Alimohamad, P. W. G. Elbers, A. R. J. Girbes, P. J. M. Weijs and H. M. Oudemans-van Straaten (2016). “Ventilator-derived carbon dioxide production to assess energy expenditure in critically ill patients: proof of concept.” Critical care 19(1): 1-10.
Steven, B. R. and S. Carey (2015). “Nutritional management in patients with chyle leakage: a systematic review.” European journal of clinical nutrition 69(7): 776-780.
Theilla, M., S. Rattanachaiwong, I. Kagan, M. Rigler, I. Bendavid and P. Singer (2021). “Validation of GLIM malnutrition criteria for diagnosis of malnutrition in ICU patients: An observational study.” Clinical Nutrition 40(5): 3578-3584.
van Schijndel, R. J. M. S., N. J. Wierdsma, E. M. B. Van Heijningen, P. J. M. Weijs, S. D. W. de Groot and A. R. J. Girbes (2006). “Fecal energy losses in enterally fed intensive care patients: an explorative study using bomb calorimetry.” Clinical Nutrition 25(5): 758-764.
Velzeboer L, Huijboom M, Weijs P, et al. Hoe berekenen we de eiwitbehoefte bij ondergewicht en overgewicht? 2017. Online beschikbaar via: NTVD-1_2017_WA_Gallagher.pdf (zakboekdietetiek.nl)
Weir, J. B. d. V. (1949). “New methods for calculating metabolic rate with special reference to protein metabolism.” The Journal of physiology 109(1-2): 1.
Wernerman, J., K. B. Christopher, D. Annane, M. P. Casaer, C. M. Coopersmith, A. M. Deane, E. De Waele, G. Elke, C. Ichai and C. J. Karvellas (2019). “Metabolic support in the critically ill: a consensus of 19.” Critical care 23(1): 1-10.
Wierdsma, N. J., J. H. C. Peters, P. J. M. Weijs, M. B. Keur, A. R. J. Girbes, A. A. van Bodegraven and A. Beishuizen (2011). “Malabsorption and nutritional balance in the ICU: fecal weight as a biomarker: a prospective observational pilot study.” Critical Care 15(6): R264.
Wischmeyer, P. E. (2018). “Nutrition therapy in sepsis.” Critical care clinics 34(1): 107-125.
Wischmeyer, P. E. and I. San-Millan (2015). “Winning the war against ICU-acquired weakness: new innovations in nutrition and exercise physiology.” Critical care 19(3): 1-14.
Woodworth, A., M. A. Thompson, T. Rice and S. Bissonnette (2019). “Biochemical and Hematological Markers of Inflammation Accurately Predict Sepsis and its Severity in ICU Patients.” Sysmex Journal International 29(1).
Zusman, O., I. Kagan, I. Bendavid, M. Theilla, J. Cohen and P. Singer (2019). “Predictive equations versus measured energy expenditure by indirect calorimetry: a retrospective validation.” Clinical nutrition 38(3): 1206-1210.
Zusman, O., M. Theilla, J. Cohen, I. Kagan, I. Bendavid and P. Singer (2016). “Resting energy expenditure, calorie and protein consumption in critically ill patients: a retrospective cohort study.” Critical care 20(1): 367.

Dit artikel is eerder verschenen in het vaktijdschrift Voeding & Visie. Diëtisten in Nederland kunnen het tijdschrift kosteloos ontvangen. Niet ontvangen? Abonneren kan door hier te klikken.



