
Postprandiale glucoserespons bij diabetes type 1
9 oktober 2019Postprandiale glucoserespons na de consumptie van drie gemengde maaltijden op basis van de koolhydraattelmethode bij volwassenen met diabetes type 1. Een gerandomiseerde studie met crossover design.
Origineel artikel: Postprandial glucose response after the consumption of three mixed meals based on the carbohydrate counting method in adults with type 1 diabetes. A randomized crossover trial. Clinical Nutrition ESPEN (2019), https://doi.org/10.1016/j.clnesp.2019.03.002 (gebruiken als referentie bij verwijzing naar dit artikel).
Emilia Papakonstantinou¹, Kleopatra Papavasiliou¹, Chrystalleni Maouri², Emmanuella Magriplis¹, Stavros Pappas³, Stavros Bousboulas³, Anastasios Koutsovasilis³, Maria Pappas³, Alexis Sotiropoulos³, Meropi D Kontogianni²
¹Unit of Human Nutrition, Department of Food Science and Human Nutrition, Agricultural University of Athens, Athens, Greece, ²Department of Nutrition and Dietetics, Harokopio University, Athens, Greece, ³Third Pathology Clinic, Diabetes Center, Nice General Hospital, Athens, Greece
Auteur met wie gecorrespondeerd kan worden:
Emilia Papakonstantinou
Unit of Human Nutrition,
Department of Food Science and Human Nutrition
75 Iera Odos, GR-11855 Athens, Greece,
Tel: +30-210-5294967, Fax: +30-210-5294967
Email: emiliap@aua.gr
Kernwoorden: koolhydraattelmethode, extra vierge olijfolie, glucose, diabetes type 1
Highlights
- De koolhydraattelmethode blijkt effectief en efficiënt.
- Wanneer extra vet wordt toegevoegd aan een hoog calorische maaltijd, leidt dit tot langduriger glucoseverhoging.
Samenvatting
Achtergrond en doel:
Mensen die intensieve insulinetherapie krijgen, berekenen normaal gesproken de benodigde hoeveelheid maaltijdinsuline aan de hand van de koolhydraten die ze eten (RED: koolhydraattelmethode). Maar er zijn ook aanwijzingen om naast koolhydraten rekening te houden met de hoeveelheid eiwit en vet in de maaltijd bij de berekening van de maaltijdinsuline. Wij hebben bij volwassenen met diabetes type 1 de effectiviteit van de koolhydraattelmethode na de consumptie van samengestelde maaltijden onderzocht en bekeken wat het effect was van de toevoeging van ‘extra vierge’ olijfolie aan deze maaltijden.
Methode
Twintig volwassenen (35.0±8.9 jaar oud, BMI 27±5 kg/m2) met diabetes type 1 (gedurende een periode van 17±11 jaar) die behandeld werden met intensieve insulinepentherapie, kregen 3 verschillende samengestelde maaltijden: een Grieks lasagne gerecht (‘pasticcio’), kip met groenten en gebakken bonenschotel (‘backed giant beans’), mét en zonder toevoeging van 11 ml ‘extra vierge’ olijfolie (in totaal dus 6 verschillende maaltijden), in willekeurige volgorde. De maaltijdinsulinedosis werd bepaald met behulp van de koolhydraattelmethode. Capillaire bloedglucose werd gemeten vóór de maaltijd (baseline) en 30, 60, 90, 120, 150 en 180 minuten na de maaltijd. Bij ieder studiebezoek werden bij de deelnemers antropometrische metingen gedaan en werd hun subjectieve stresslevel bepaald.
Resultaten
Deelnemers hadden een gemiddeld HbA1c van 7.5±1.2% (= 58±12 mmol/mol), een gemiddelde koolhydraat: insulineratio van 9:1 eenheden en een stabiel gewicht, middelomvang en subjectief stres niveau gedurende de gehele studie. De gemiddelde glucoseconcentratie 120 minuten postprandiaal (RED: na de maaltijd) was voor alle 6 de maaltijden in bijna 80% van de gevallen binnen de streefwaarden (<180 mg/dl of 10 mmol/l). Toevoeging van olijfolie aan de Griekse pasticcio maaltijd leidde tot langduriger hogere bloedglucosewaarden (alhoewel binnen de streefwaarden); er werd geen verschil waargenomen in bloedglucosewaarden na de maaltijden met kip en groenten of de bonenschotel (RED: mét of zonder olijfolie).
Conclusies
De koolhydraattelmethode was effectief in het bereiken van postprandiale bloedglucosewaarden binnen de streefwaarden tot 3 uur na de maaltijd. De toevoeging van kleine hoeveelheden olijfolie aan laag-vet maaltijden veranderde de postprandiale glucoserespons niet significant binnen de eerste 3 uur, terwijl deze toevoeging aan een energierijke maaltijd (Griekse pasticcio) resulteerde in langduriger hogere postprandiale bloedglucosewaarden.
Inleiding
Het bereiken van optimale glykemische controle bij mensen met diabetes type 1 (T1D) die intensieve insulinebehandeling krijgen, is een uitdaging voor zowel clinici, diëtisten als patiënten. De frequente zelfcontrole van de bloedglucose, de juiste inschatting van de snelwerkende insulinedosis voor de maaltijden, de verschillende technieken die worden gebruikt door mensen op pentherapie vs. continue subcutane insuline-infusie (insulinepomp), het juiste gebruik van de individuele correctiefactor (RED: de insulinegevoeligheidsfactor: hoeveel daalt de bloedglucose bij correctie met 1 EH snelwerkende insuline), de complexiteit van voedingsvoorlichting met betrekking tot het aanpassen van de snelwerkende insuline op de maaltijden en de angst van patiënten voor hypoglykemische episodes zijn enkele van de factoren waardoor een strakke glykemische controle lastig te bereiken is voor een individu met T1D. De afgelopen jaren is duidelijk geworden dat het belangrijk is om bloedglucoseschommelingen te voorkomen, omdat dat deze oxidatieve stress en schade aan de bèta-cellen (RED: pancreascellen die insuline maken) kunnen veroorzaken bij mensen met diabetes (Ceriello, 2008). Een wisselende glucosewaarde met pieken en dalen is tevens een erkende metabole afwijking die kan leiden tot hart- en vaatziekten bij mensen met diabetes (Monnier, 2009).
Van alle macronutriënten beïnvloeden met name koolhydraten de glykemische respons en zijn daarom de belangrijkste voedingscomponent om rekening mee te houden voor het bereiken van een stabiele glucosespiegel bij T1D (Kawamura, 2007; Dyson, 2011; ADA, 2018). Het gebruik van koolhydraten verhoogt de postprandiale glucoseconcentraties op een dosisafhankelijke manier (Kawamura, 2007; Meng, 2017). Het afstemmen van insuline op de hoeveelheid geconsumeerde koolhydraten, de zogenaamde koolhydraattelmethode, is een effectieve strategie om de glucosespiegel onder controle te houden (Dyson, 2011; ADA, 2018). De voordelen van deze methode zijn onder meer een nauwkeurigere afstemming van de insulinebehoefte op geconsumeerde koolhydraten en de flexibiliteit in voedingskeuzes (Maahs, 2012). Meta-analyses van gerandomiseerde gecontroleerde klinische studies (RCT’s) en recente RCT’s bij volwassenen met T1D hebben aangetoond dat de koolhydraattelmethode de glykemische controle kan verbeteren (verlaging van geglyceerd hemoglobine (HbA1c) tot 1,2% (12 mmol/mol)), en kan leiden tot een verbeterde kwaliteit van leven, algemeen welzijn en vermindering van hypoglykemische episodes (Bell, 2014; Schmidt, 2014; Souto, 2014; Fu, 2016; Hommel, 2017). De systematische review en meta-analyse van Bell et al. (Bell, 2014) toonde aan dat de koolhydraattelmethode leidt tot een klinische en statistisch significante vermindering van het HbA1c met ongeveer 0,6% (RED: 6 mmol/mol) bij volwassenen.
Echter, er zijn aanwijzingen dat ook het eiwit- en vetgehalte van een maaltijd effect kan hebben op de postprandiale bloedglucoseconcentraties, wat de effectiviteit van de koolhydraattelmethode kan beïnvloeden. Enkele kleine interventiestudies suggereren dat een hoge inname van eiwit de postprandiale glucoseconcentraties op een dosisafhankelijke manier kan verhogen (Bell, 2015; Paterson, 2016; Paterson, 2017). Andere studies suggereren dat een hoge vetinname een vertraagde stijging van postprandiale glucoseconcentraties en een langdurige postprandiale hyperglykemie veroorzaakt (Lodefalk, 2008; Wolpert, 2013; Bell, 2015) en weer andere studies suggereren dat de combinatie van grote hoeveelheden eiwit en vet in energierijk voedsel de postprandiale bloedglucoseconcentratie aanzienlijk verhoogt. Dit laatste leidt tot een verhoging van de behoefte aan snelwerkende insuline met 1 tot 3 eenheden per maaltijd (MacDonald, 2009; Pankowska, 2010; Kordonouri, 2012; Bell, 2014). Eén studie liet niet zien dat een grote inname van eiwit en vet de postprandiale glucosepiek verhoogde, maar wel dat de duur van de postprandiale hyperglykemie langer was (van der Hoogt, 2017). Echter, rekening houden met de hoeveelheid eiwit en/of vet bij het inschatten van de insulinebehoefte leidt ook tot ernstige hypoglykemische episodes (Pankowska, 2010; Kordonouri, 2012).
Hoewel een langdurige postprandiale hyperglykemie een belangrijk probleem is bij glucosecontrole, richt voedingseducatie bij mensen met diabetes zich met name op de bloedglucosewaarden 2 uur na de maaltijd. Voor mensen met T1D op pentherapie is het daarom lastig hun individuele behoefte aan snelwerkende maaltijdinsuline zo in te schatten dat hun bloedglucose binnen 2-3 uur na de maaltijd op de streefwaarde is.
Met het oog op de bovengenoemde effecten van macronutriënten op de glykemische respons bij mensen met T1D, waren de doelstellingen van deze studie: a) om de effectiviteit van de koolhydraattelmethode te onderzoeken bij het binnen 3 uur na de maaltijd bereiken van postprandiale bloedglucoseconcentraties binnen de streefwaarden bij mensen met T1D, na consumptie van 3 typisch Griekse gemengde maaltijden met gevarieerde macronutriëntenprofielen (om een real life situatie na te bootsen) en b) om het effect op de glykemische respons van de deelnemers te onderzoeken van de toevoeging een kleine hoeveelheid ‘extra vierge’ olijfolie – die veel gebruikt wordt bij de bereiding van voedsel in Griekenland – aan de 3 bovengenoemde maaltijden.
Populatie en methode
Populatie
Volwassenen (mannen en vrouwen van 18-55 jaar) met T1D (>2 jaar), die niet rookten kwamen in aanmerking voor deze studie. De deelnemers werden geworven via aanplakbiljetten in het poliklinische diabetescentrum van het Algemeen Ziekenhuis van Nice (Piraeus, Griekenland) en bij de Landbouwuniversiteit van Athene. Inclusiecriteria waren behandeling met meerdere dagelijkse insuline-injecties (snelwerkende analogen: insuline lispro, glulisine en asparts) en het gebruik van lang werkende insuline-analogen (insuline glargine of insuline detemir) gedurende minstens 6 maanden. De exclusiecriteria omvatten insulinepomptherapie, zwangerschap, borstvoeding, coeliakie, ernstige micro- en macrovasculaire diabetescomplicaties – waaronder autonome neuropathie, elke andere chronische ziekte naast diabetes (bv. coronaire hartziekte, lever- of nieraandoeningen), maag- en darmstoornissen, deelname aan wedstrijdsporten en hoge alcoholconsumptie. Patiënten die aan de inclusiecriteria voldeden en zich voldoende compliant opstelden t.a.v. het doel van de studie, werden gevraagd om deel te nemen aan de studie. De opzet van de studie en de haalbaarheid van deelname werden besproken met de deelnemers, in het bijzonder betreffende hun werkroosters en leefgewoonten. Het protocol werd goedgekeurd door de Medisch Ethische Commissie van het Algemeen Ziekenhuis van Nice (Piraeus, Griekenland), uitgevoerd in overeenstemming met de Verklaring van Helsinki (1997) en geregistreerd via ClinicalTrials.gov NCT02928016. Alle patiënten hebben schriftelijk toestemming gegeven voor deelname aan het onderzoek.
Studiedesign
De interventie werd voorafgegaan door een inloopperiode van gemiddeld 14 dagen waarin patiënten voedingsvoorlichting ontvingen van onderzoeksdiëtisten en het medische team. Tijdens deze periode hadden de deelnemers drie persoonlijke ontmoetingen en dagelijkse telefonisch contact met de onderzoeksdiëtisten en artsen om de optimale pre- en postprandiale glucoseconcentraties te bereiken voordat zij aan het onderzoek deelnamen. De deelnemers hielden twee 7-daagse voedingsdagboeken en hun capillaire bloedglucosewaarden vóór en 2 uur na de maaltijd of snack consumptie bij om de behoefte aan basale insuline te optimaliseren en om de koolhydraat : insulineratio en de insulinecorrectiefactor per patiënt te berekenen. Tijdens de inloopperiode kregen de mensen de opdracht om hun gebruikelijke maaltijden en snacks te nuttigen, die verschillende hoeveelheden koolhydraten bevatten, variërend van 15 tot 75 gram. De berekende koolhydraat : insulineratio en insulinecorrectiefactor per patiënt werden vervolgens gedurende het gehele onderzoek gebruikt. Na de inloopperiode werden de deelnemers volgens een gerandomiseerd cross-over-design met behulp van computersoftware, willekeurig aan (RED: een volgorde van) interventies (RED: testmaaltijden) toegewezen. Een onderzoeker die niet betrokken was bij het verzamelen en analyseren van de data, was verantwoordelijk voor de randomisatie van de deelnemers over de interventiedagen. De laatste correctiedosis van snelwerkende insuline moest 12-15 uur vóór de studiedag zijn gegeven en de laatste langwerkende insulinecorrectie 48 uur voor de studiedag. De onderzoeksdiëtisten namen de avond vóór en de ochtend van elke studiedag contact op met de deelnemers om zeker te weten dat de deelnemers geen hypo- of hyperglykemie hadden doorgemaakt. In het geval van een hypoglykemie (bloedglucose <65 mg/dL (= <3,6 mmol/l)), hyperglykemie (preprandiale bloedglucose >130 mg/dL (= 7,3 mmol/l) of postprandiale bloedglucose >180mg/dL (10 mmol/l)) werd de testprocedure op een andere dag gepland. In de ochtend voorafgaand aan de testmaaltijden consumeerden alle patiënten hetzelfde lichte ontbijt om vertekening van het effect van de tweede maaltijd te voorkomen. Zij werden ook gevraagd om inspannende fysieke activiteiten op de dag vóór en op de ochtend van de testmaaltijd te vermijden. De dosis insuline vóór de maaltijd, die net voor het eten werd geïnjecteerd, was gebaseerd op de individuele insuline : koolhydratenratio die tijdens de inloopperiode van de studie was bepaald. Zo waren de insulinedoses per patiënt hetzelfde voor elke gemengde maaltijd, zonder of met toevoeging van ‘extra vierge’ olijfolie. De deelnemers kwamen in totaal 6 keer tussen 12.00 en 13.00 uur naar het poliklinisch Diabetescentrum van het Algemeen Ziekenhuis van Nice (Peiraeus, Griekenland) met een ‘wash-out’-periode van 1 week tussen de studiedagen. Deelnemers ontvingen 3 kant-en-klare gestandaardiseerde typisch Griekse gemengde maaltijden [pasticcio (een gerecht gemaakt met dikke pasta, gehakt rundvlees en béchamelsaus), gegrilde kip met gekookte groenten en gebakken reuzenbonen (gigantes)] (Sklavenitis, SA, Peristeri, Griekenland) zonder en met toevoeging van 11 ml ‘extra vierge’ olijfolie, gedurende verschillende weken in een willekeurige volgorde. Het koolhydraatgehalte (in gram) dat werd gebruikt voor de berekening van de dosis insuline vóór de maaltijd werd bepaald aan de hand van de voedseletiketten van Sklavenitis SA. Patiënten deden steeds op dezelfde tijd en dag van de week mee, waardoor de mogelijkheid van verstorende effecten van verschillende dagen van de week werd uitgesloten. De testmaaltijden werden vers bereid op de dag van het testen en geserveerd door de onderzoeksdiëtisten die ook aanwezig waren tijdens de consumptie ervan door de deelnemers.
Test Maaltijd Samenstelling
De typische Griekse gemengde maaltijden verschilden in samenstelling van macronutriënten, om een real life setting na te bootsen (tabel 1). Kip met groenten werd gekozen als een eiwitrijke, koolhydraatarme (niet-zetmeel), vetarme maaltijd. Gebakken reuzenbonen werden gekozen als peulvruchtengerecht dat hoog in complexe koolhydraten en voedingsvezels en laag in vetgehalte was. Pasticcio werd gekozen als een maaltijd met een hoge energiedichtheid (waarvan de calorieën naast de koolhydraten met name uit vet afkomstig zijn). Olijfolie van de eerste persing (‘extra vierge’) die in Griekenland vaak wordt gebruikt bij het koken, werd gekozen als de bron van enkelvoudig onverzadigd vet. Vlak voor consumptie werd 11 ml olijfolie toegevoegd aan de maaltijd en de onderzoeksdiëtisten zorgden ervoor dat de volledige hoeveelheid werd geconsumeerd.
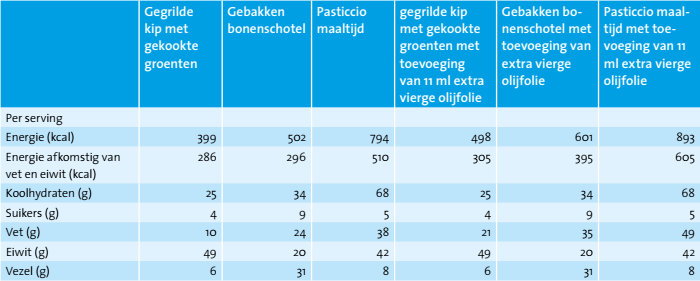
Metingen
Om de bloedglucoseconcentraties te bepalen, voerden getrainde leden van ons onderzoeksteam de capillaire bloedglucosecontroleprocedure uit met behulp van een vingerprik op vastgestelde tijden. Om alle procedures voor het verzamelen van gegevens te standaardiseren werd de bloedglucosemeting uitgevoerd aan de vingertop van de derde vinger. De deelnemers konden zelf kiezen welke hand. Capillaire bloedmonsters werden verzameld voor het eten en 30, 60, 90, 120, 150 en 180 minuten na het eten. Alle bloedglucosemetingen werden uitgevoerd met behulp van de FORA Comfort lux GD50 bloedglucosemeter (ATCARE ltd, Griekenland). De bloedglucose werd gemeten met glucose dehydrogenase FAD-afhankelijke (GDH – FAD) teststroken die niet reageren op andere suikers dan glucose en hitte- en zuurstofbestendig zijn. De toegestane afwijkingen van glucosemeters voor glucoseresultaten ≥ 100 mg/dL (5.5 mmol/l) lagen binnen 15% van de referentiemethode. De variatiecoëfficiënt (CV, %) was minder dan 5%, zowel wat betreft de gemiddelde precisie als de reproduceerbaarheid. De geregistreerde bloedglucosewaarde was het gemiddelde van drie metingen. Het streefbereik na 2 uur werd vastgesteld tussen 70 en 180 mg/dl (3.9-10 mmol/l) (ADA, 2018). De postprandiale incrementele bloedglucose van 0-3 uur (iAUC, incremental Area Under the Curve) werd berekend met de trapeziummethode, waarbij het gebied onder de curve, boven de uitgangswaarde waarde werd bepaald. De bloedglucosepiek werd berekend als de maximale afwijking van de nuchtere glucosewaarde over een periode van 3 uur. De tijd tot de bloedglucosepiek werd berekend als het tijdstip waarop de maximale glucosewaarde werd waargenomen. We corrigeerden voor de weinige hypoglykemiën (bloedglucosewaarde <65 mg/dL of 3.6 mmol/l) die optraden, door de laatst geregistreerde bloedglucosewaarde vóór de behandeling van de hypoglykemie te gebruiken voor de berekening van iAUC-bloedglucose. Tijdens de inloopperiode werden nuchtere bloedmonsters verzameld voor biochemische analyse. HbA1c werd gemeten met een RXDaytona-analysator (Randox Laboratoria, MA, USA). Het totale cholesterol (mmol/L), triglyceriden (mmol/L), en lipoproteïne cholesterol met hoge dichtheid (HDL-c) (mmol/L) werden gemeten met behulp van de AEROSET/ARCHITECT c8000 System (Abbott, Chicago, IL, USA). Het lage dichtheid lipoproteïne cholesterol (LDL-c) werd berekend met de Friedewald formule (Friedewald, 1972).
Dieet, lichaamsbeweging en psychologische metingen
Voorafgaand aan de studie werden de voedingsgewoonten beoordeeld aan de hand van een semi-kwantitatieve voedselfrequentie vragenlijst en werd de kwaliteit van het gebruikelijke dieet beoordeeld aan de hand van de MedDietScore die de naleving van het mediterrane voedingspatroon beoordeelt (Panagiotakos, 2006). Het bereik van de dieetscore is 0 – 55, waarbij hogere waarden wijzen op meer naleving van het mediterrane dieet. Bij elk bezoek werd een 24-uurs recall voedingsanamnese uitgevoerd. Zowel de 24-uurs recall voedingsanamneses als de 7-daagse voedingsdagboeken, die werden gebruikt voor het schatten van de koolhydraat : insulineratio, werden geanalyseerd met behulp van Diet Analysis Plus software (versie 6.1, ESHA Research, OR, USA). De database werd grondig aangepast door er nieuwe voedingsmiddelen en recepten in op te nemen. De fysieke activiteit van de deelnemers werd beoordeeld aan de hand van een gevalideerde vragenlijst [de Athens Physical Activity Questionnaire (APAQ)] (Kavouras, 2016). Deze vragenlijst inventariseert zelf gerapporteerde lichamelijke activiteit van de voorgaande week en de tijd die is besteed aan lichte, matige, intensieve activiteiten en slaap. Op basis van de metabole equivalenten van alle activiteiten werd het gemiddelde dagelijkse energieverbruik en het niveau van de fysieke activiteit (PAL) geschat. De reden om het gebruikelijke voedings- en bewegingspatroon na te vragen was om te voorkomen dat de deelnemers dit zouden veranderen, omdat dit van invloed zou kunnen zijn op de glykemische respons. De onderzoeksdiëtisten controleerden deze gegevens en begeleidden indien nodig de deelnemers. Bij elk bezoek vulden de deelnemers de Zung self-rating depression scale (Fountoulakis, 2001) en de Zung self-rating anxiety scale (Samakouri, 2012) in om naast de fysiologische ook de psychologische toestand van de deelnemers te bepalen en om zeker te zijn dat de bloedglucoserespons niet door bijkomende factoren was beïnvloed, zoals intense psychologische stress, depressie of angst. Elke vragenlijst bestond uit 20 vragen. De range van elke vragenlijst lag tussen de 20 en 80, waarbij hogere waarden wezen op een slechtere psychologische toestand en meer stress en de lagere waarden op een betere psychologische toestand en minder stress.
Antropometrische metingen
Voor aanvang van de studie werd de lengte (cm) gemeten. Het lichaamsgewicht (kg), de tailleomtrek (cm) en heupomtrek (cm) werden bij elk bezoek gemeten om de stabiliteit van het lichaamsgewicht te bewaken. De BMI (kg/m2) werd hieruit berekend.
Statistische analyse
De distributie van de data werd getest met behulp van kernel density plots. Normaal verdeelde continue variabelen worden gepresenteerd als gemiddelde waarden ± standaarddeviatie van het gemiddelde (SEM), tenzij anders vermeld. Verschillen in uitgangswaarden van continue variabelen werden geëvalueerd met behulp van variantieanalyse (ANOVA) voor normaal verdeelde continue variabelen, Kruskal-Wallis test voor niet normaal verdeelde continue variabelen en de Pearson chi square test voor categorische variabelen. Om de belangrijkste effecten tussen de behandelingen (RED: testmaaltijden) te analyseren, werd een variantieanalyse (ANOVA) in een 2×2 crossover design uitgevoerd. In een 2×2-design wordt aangenomen dat er geen groepseffecten zijn, aangezien er een volledig randomisatieproces werd gevolgd voor de toewijzing van de behandeling. In de modellen werden de factoren “deelnemer” (id), “volgorde” voor variatie binnen 1 persoon, “periode” en “behandelingen” meegenomen om rekening te houden met variabiliteit tussen deelnemers. De interactie tussen tijd x testmaaltijd werd geëvalueerd. Volgens de berekening van de steekproefgrootte was een totaal van 13 vrijwilligers nodig om 80% power te bereiken met een tweezijdig 0,05 significantieniveau, voor het detecteren van een klinisch verschil van 25 (SD 30) mg/dL in een gemiddeld bloedglucoseverschil tussen de behandelingen (gemengde maaltijd met en zonder toevoeging van olijfolie). De statistische significantie werd vastgesteld op p <0,05. Alle analyses werden uitgevoerd met behulp van SPSS-software (versie 20.0, SPSS Inc., USA).
Resultaten
Patiënten karakteristieken
De gemiddelde leeftijd van de deelnemers (9 mannen en 11 vrouwen; tabel 2) was 35,0 ± 8,9 jaar en de gemiddelde BMI 27,3 ± 4,9 kg/m2. De diabetes bestond 16,7 ± 10,9 jaar en deelnemers hadden een acceptabele bloedglucosecontrole (HbA1c 7,5 ± 1,2%). Hun totale dagelijkse insulinedosis was 42,2 ± 11,0 IE en hun gemiddelde berekende koolhydraat (g) : insuline (eenheden) ratio was 9,1 ± 3,9 g per 1 IE.
Alle deelnemers scoorden matig wat betreft naleving van het mediterrane dieet (gemiddelde MedDiet Score van 29.6 ± 4.3). De deelnemers hadden gedurende het hele onderzoek een lager dan gemiddelde (zelf gerapporteerde) score wat betreft depressie en angstniveaus (data hier niet weergegeven). BMI, taille- en heupomvang, subjectieve stress en PAL bleven stabiel gedurende het onderzoek (data hier niet weergegeven, allen p>0,05).
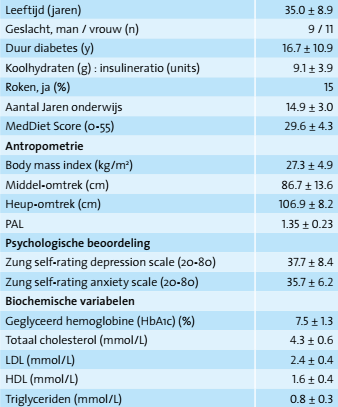
Waarden zijn gemiddelden ± SD. Afkortingen: MedDiet: Meditteraan Dieet; PAL: Physical Activity Level (RED: Fysiek Aciviteiten Niveau); LDL: Low Density Lipoprotein (RED: lipoproteïne met lage dichtheid); HDL: High Density Lipoprotein (Lipoproteïne met hoge dichtheid).
Maaltijd-insulinedosis
De dosis maaltijdinsuline die toegediend werd vóór het eten, werd bepaald op basis van de individuele koolhydraat : insulineratio en de hoeveelheid koolhydraten op de voedseletiketten van maaltijden, zonder rekening te houden met de toevoeging van ‘extra vierge’ olijfolie.
Glykemisch effect
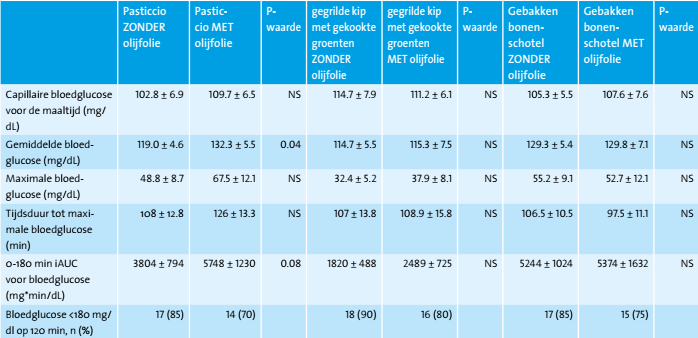
De koolhydraattelmethode was effectief voor wat betreft het bereiken van de beoogde bloedglucosewaarden binnen 2 uur na alle testmaaltijden en varieerde van 85-90% bij de maaltijden zonder toevoeging van ‘extra vierge’ olijfolie (tabel 3). Wanneer extra olijfolie aan de maaltijden werd toegevoegd, werden de bovengenoemde percentages verlaagd van 85% naar 70% voor de pasticcio maaltijd, van 90% naar 80% voor de gegrilde kip met gekookt groenten en van 85% naar 75% voor de gebakken bonenschotel, ofschoon deze dalingen niet significant waren (alle p>0,05) (Tabel 3). Er trad een beperkt aantal milde asymptomatische hypoglykemiën op (kip met gekookte groenten: 2 van de 20 zonder toegevoegde olijfolie en 4 van de 20 met toegevoegde olijfolie; gebakken bonenschotel: 1 van de 20 zonder toegevoegde olijfolie en 2 van de 20 met toegevoegde olijfolie; pasticcio: 1 op de 20 zonder toegevoegde olijfolie en 1 op de 20 met toegevoegde olijfolie). Er waren geen significante verschillen in het aantal hypoglykemische episoden na de drie maaltijden, zonder of met toegevoegde olijfolie.
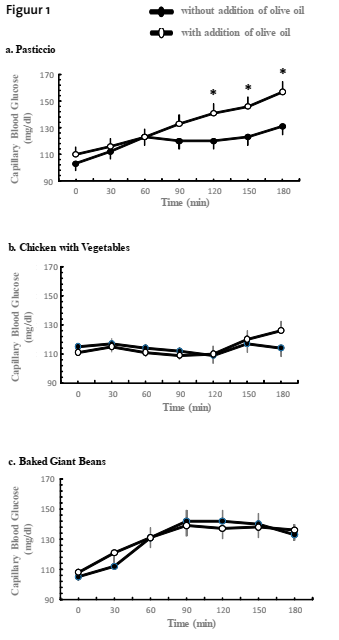
Er was geen significant verschil in nuchtere glucoseconcentraties vóór de verschillende testmaaltijden, zonder of met toevoeging van olijfolie (p voor alle maaltijden >0,05; Figuur 1a, 1b, 1c). Er was een significant effect van maaltijd op de gemiddelde bloedglucoseconcentraties en op de glucose iAUC van 0-3 uur na de maaltijd (p=0,04 en p=0,04, respectievelijk). Toevoeging van 11 ml ‘extra vierge’ olijfolie verhoogde de postprandiale bloedglucose respons alleen na de pasticcio maaltijd (p<0.05), maar had geen significante invloed op het totale bloedglucoseprofiel na de gegrilde kip met groenten en na de gebakken bonenschotel (alle p>0.05; Figuur 1a, 1b, 1c).
Vergeleken met pasticcio zonder toevoeging van olijfolie, werden na de consumptie van pasticcio met toevoeging van olijfolie hogere bloedglucoseconcentraties gezien op 150 min en 180 min na de maaltijd (p=0.03 en p=0.01, respectievelijk; Figuur 1a). De gemiddelde bloedglucoseconcentraties waren significant hoger na consumptie van pasticcio met toevoeging van olijfolie in vergelijking met pasticcio zonder toevoeging van olijfolie (p=0,04; tabel 3). Drie uur na de consumptie van pasticcio zonder toevoeging van ‘extra vierge’ olijfolie was er een trend richting hogere glucoseconcentraties dan voor de maaltijd, hoewel dat niet statistisch significant was (p=0,051; figuur 1a). Drie uur na de consumptie van pasticcio mét toevoeging van ‘extra vierge’ olijfolie waren de glucoseconcentraties significant hoger in vergelijking met voor de maaltijd (p=0,009; figuur 1a). Dienovereenkomstig was de bloedglucose iAUC van 0-3 uur na de pasticcio mét toegevoegd ‘extra vierge’ olijfolie hoger dan zonder toegevoegde olijfolie (p=0,08; tabel 3).
De glykemische respons na de consumptie van gegrilde kip met gekookte groenten verschilde niet wanneer deze werd geconsumeerd zonder of met toevoeging van olijfolie (alle p>0.05; Figuur 1b). Drie uur postprandiaal verschilden de bloedglucoseconcentraties niet van de waarden voor de maaltijd, zowel mét als zonder toegevoegde ‘extra vierge’ olijfolie (p>0,05; figuur 1b). Ook de gemiddelde bloedglucose, iAUC van 0-3 uur na de maaltijd, piek bloedglucose niveaus en duur daarvan verschilden niet tussen gegrilde kip met gekookte groenten zonder en met toegevoegde ‘extra vierge’ olijfolie (alle p>0.05; Tabel 3).
Ook de glykemische respons na de consumptie van de gebakken bonenschotel verschilde niet wanneer ze werden geconsumeerd zonder of met toevoeging van olijfolie (alle p>0.05; Figuur 1c). Drie uur na consumptie van gebakken bonenschotel waren de bloedglucoseconcentraties postprandiaal significant hoger in vergelijking met voor de maaltijd, waarbij de toevoeging van ‘extra vierge’ olijfolie niet uitmaakte (alle p>0.05; Figuur 1c). De gemiddelde bloedglucosewaarde, iAUC van 0-3 uur, piek bloedglucose niveaus en duur daarvan verschilden ook niet tussen gebakken bonenschotel zonder en met toegevoegde ‘extra vierge’ olijfolie (alle p>0.05; Tabel 3).
Discussie
In deze studie bevestigden we de effectiviteit van de koolhydraattelmethode na de consumptie van 3 typische Griekse gemengde maaltijden met gevarieerde macronutriëntprofielen, waarmee we ‘real life’ omstandigheden hebben nagebootst bij volwassenen met T1D op intensieve insuline-pentherapie. De maaltijden werden geconsumeerd zonder en met toevoeging van ‘extra vierge’ olijfolie. Het toevoegen van kleine hoeveelheden olijfolie aan vetarme maaltijden veranderde de postprandiale respons in de eerste 3 uur niet significant. Echter, de toegevoegde kleine hoeveelheid ‘extra vierge’ olijfolie veroorzaakte een aanhoudende stijging van de postprandiale bloedglucoseconcentraties bij de meest energie- en vetrijke maaltijd (d.w.z. de pasticcio maaltijd met 49 gram vet).
Het bereiken van de postprandiale bloedglucosewaarden binnen de streefwaarden in T1D is een complexe kwestie, omdat de bloedglucosewaarden aanzienlijk worden beïnvloed door meerdere factoren zoals preprandiale bloedglucosewaarden, timing en wijze van insulinetoediening, insulinegevoeligheid, insulinedosering, lichaamsbeweging, stress, andere medicijnen en ziekte (Bevier, 2007). De effectiviteit en efficiëntie van de koolhydraattelmethode in T1D zijn uitgebreid beschreven (Kawamura, 2007; Scavone, 2010; Dyson, 2011; Tascini, 2018). Wanneer de geïndividualiseerde koolhydraat : insulineratio nauwkeurig wordt geschat, ligt de waarschijnlijkheid van de juiste insulinedosering tussen de 50,1% en 98,5% (Virdi, 2012). In onze studie werd de berekening van de dosis maaltijdinsuline gebaseerd op de hoeveelheid, maar niet op het type koolhydraten en werd in bijna 80% van de gevallen de beoogde postprandiale bloedglucosewaarde bereikt. Bovendien wordt het gebruik van de koolhydraattelmethode geassocieerd met het weinig vóórkomen van hypoglykemie, zoals aangetoond in onze en eerdere studies (Dyson, 2011; Maahs, 2012; Schmidt, 2014; ADA, 2018). Daarentegen werd een verhoogde frequentie (bijna 36%) van hypoglykemische episodes (bloedglucose <70 mg/dl of 3,9 mmol/l) gerapporteerd wanneer eiwit en vet werden meegenomen in de berekening van de dosis maaltijdinsuline versus slechts 10% wanneer alleen koolhydraten werden meegerekend (Kordonouri, 2012).
Wat betreft de effecten van eiwit en vet op de postprandiale glucoseconcentraties zijn er nog steeds veel tegenstrijdige meningen en data. Zelfs de officiële Diabetes Associaties lijken verschillende standpunten in te nemen over deze kwestie, waarbij de American Diabetes Association suggereert dat “mensen die maaltijden met meer eiwitten en vet dan gewoonlijk eten, ook de dosis maaltijdinsuline moeten aanpassen om te compenseren voor vertraagde postprandiale hyperglykemie” (ADA, 2018) en de U.K. Diabetes Association vaststelt dat “gezien het niveau van het huidige bewijs en de omvang van het effect van vet en eiwit op postprandiale glucosewaarden, er meer bewijs nodig is om routinematige inzet van het tellen van vet en eiwit in de klinische praktijk te rechtvaardigen” (Dyson, 2011). Kort gezegd suggereren sommige interventiestudies dat eiwitinname de bloedglucoseconcentraties niet verhogen binnen 2-3 uur na de maaltijd (Klupa, 2015; van der Hoogt, 2017), maar dat het de duur van een postprandiale hyperglykemie kan verlengen (Smart, 2013; Bell, 2015; Paterson, 2016; van der Hoogt, 2017). Anderen hebben aangetoond dat maaltijden die tussen de 28 en 57 g eiwit bevatten leiden tot aanzienlijk hogere postprandiale glucosewaarden en daarom in vergelijking met standaard maaltijden de insulinebehoefte 2 tot 5 uur postprandiaal verhogen (Peters, 1993; Winiger, 1995; Garcia-Lopez, 2013; Smart, 2013), terwijl Paterson et al. (Paterson, 2017) onlangs een dosisafhankelijk en bifasisch effect van eiwitten op de postprandiale glykemische controle aantoonden. Wat betreft het effect van vet op de glykemische respons, suggereren sommige studies dat vet in de voeding, alleen of in combinatie met eiwit, acute insulineresistentie (Wolpert, 2013), een initiële verminderde glykemische respons (Lodefalk, 2008) en een vertraagd aanhoudende hyperglykemie 3 tot 6 uur na de maaltijd (Smart, 2013; Bell, 2015; Paterson, 2017; van der Hoogt, 2017) kan veroorzaken. Recentelijk werd ook de vetkwaliteit onderzocht in een RCT, waaruit bleek dat de toevoeging van 37 g ‘extra vierge’ olijfolie aan maaltijden met een hoge glykemische index (zowel laag-vet als hoog-verzadigd vet maaltijden) de vroege (tot 3 uur) postprandiale glucoserespons verlaagde.(Bozzetto, 2016).
Overeenkomstig hebben studies met gemengde maaltijden, zoals pizza’s, spaghetti carbonara en fastfoodproducten (d.w.z. hamburger en frites), tot onduidelijke en tegenstrijdige resultaten geleid. Sommige studies hebben aangetoond dat voor deze maaltijden meer insuline moet worden toegediend (Ahern, 1993; Pankowska, 2009; Bao, 2011; Kordonouri, 2012; Wolpert, 2013), terwijl uit andere studies blijkt dat er juist minder insuline nodig is dan verwacht op basis van het tellen van alleen de koolhydraten (MacDonald, 2009; De Palma, 2011), of dat het tellen van alleen koolhydraten een voldoende en efficiënte methode is (MacDonald, 2009; De Palma, 2011; Wolpert, 2013). In onze studie varieerden de gebruikte maaltijden in zowel de hoeveelheid eiwit (range van 20-49 g) als vet (range van 10-38 g, zonder toevoeging van olijfolie) om de effectiviteit van het koolhydraattellen binnen een ruime range aan eiwit- en vetgehalte te onderzoeken. Daarnaast werd het vetgehalte verder verhoogd met de toevoeging van olijfolie, wat leidde tot een grotere vetinname (range van 22-49) g. Volgens onze resultaten had de toevoeging van een kleine hoeveelheid vet alleen invloed op de glucoserespons na de consumptie van een energierijke maaltijd (pasticcio), die al veel vet (49 g per portie) en eiwit (42 g per portie) bevatte. Dit suggereert dat er een vet- of zelfs energiedrempel is waarboven vet een aanhoudende of uitgestelde hyperglykemie oplevert. Het kan zijn dat alleen een zeer grote inname van calorieën die afkomstig zijn van vet en eiwit en niet van koolhydraten, de aanhoudende of uitgestelde hyperglykemie veroorzaken, en niet het vet of eiwit ‘an sich’, met name wanneer deze in kleinere hoeveelheden worden geconsumeerd. De pasticcio maaltijd lijkt qua eiwit- en vetcontent op de pizza en spaghetti carbonara maaltijden (Ahern, 1993; MacDonald, 2009; De Palma, 2011). In onze studie had de maaltijd met gegrilde kip en gekookte groenten het hoogste eiwitgehalte (49 gram), maar de bloedglucoseniveaus waren binnen de verwachte grenzen gedurende 3 uur na de maaltijd. Of dit ligt aan het feit dat er voor eiwit geen extra insuline nodig is of dat de insulinebehoefte verschilt voor van zetmeel of niet van zetmeel afkomstige koolhydraten (zoals in het geval van gekookte groenten in deze maaltijd), is nog onduidelijk.
Een sterk punt van deze studie is het gerandomiseerde, cross-over design. Bovendien hebben we de effectiviteit van de koolhydraattelmethode getest met maaltijden die typisch zijn voor de Griekse keuken en hebben we onderzocht wat de effecten zijn van een kleine hoeveelheid toegevoegde ‘extra vierge’ olijfolie in deze maaltijden op de acute glykemische respons. Een beperking van de studie is dat 3 uur (RED: na de maaltijd) mogelijk onvoldoende was om het volledige effect van eiwit en/of vet op de glucoserespons na te gaan. Bovendien zou het beter zijn geweest als we de plasma glucoseconcentraties hadden gemeten met behulp van een automatische analysator in plaats van met behulp van zelfgemeten (RED: door patiënten zelf gerapporteerde) bloedglucosewaarden. Bovendien werden testsessies waarbij de deelnemer een hypoglykemie kreeg, onmiddellijk beëindigd, om de hypoglykemie op de juiste manier te behandelden. In die gevallen werd de laatste geregistreerde bloedglucosewaarde gebruikt in de analyses. Als alternatief hadden we er ook voor kunnen kiezen om een consistente stijging van de bloedglucoseconcentraties te veronderstellen voor de rest van de meetperiode. Echter, het imputeren van een waarde voor ontbrekende gegevens maakt de generaliseerbaarheid van de bevindingen twijfelachtig. Hoewel we geprobeerd hebben om voor een aantal factoren te controleren waarvan bekend is dat ze het bloedglucosegehalte beïnvloeden (bijv. stress, beweging, ziekte) en gebruik hebben gemaakt van een cross-over design, kunnen we niet uitsluiten dat er nog meer confounders zijn geweest die het bloedglucosegehalte hebben beïnvloed.
Concluderend bevestigden de resultaten van onze studie de effectiviteit van de koolhydraattelmethode voor het bereiken van beoogde postprandiale bloedglucoseconcentraties binnen een periode van 3 uur na consumptie van gemengde maaltijden met verschillende hoeveelheden van macronutriënten. Het toevoegen van kleine hoeveelheden vet aan vetarme maaltijden verandert de postprandiale respons in de eerste drie uur niet significant, maar er kunnen geen conclusies worden getrokken wat betreft vetrijke maaltijden, extra eiwitten of langere periodes (RED: betreffende de bloedglucoserespons). Op basis van de huidige resultaten en de relevante literatuur is het voor patiënten met T1D nog steeds onduidelijk of het toevoegen van eiwit en vet aan de puzzel van de berekening van maaltijdinsuline klinisch zinvol is. In plaats daarvan is het beter dat patiënten die meerdere keren per dag insuline spuiten, iedere 2-3 uur na de maaltijd hun bloedglucosewaarde testen, zoals ook al wordt aanbevolen door veel wetenschappelijke verenigingen.
Dankwoord en verantwoording:
Dit werk werd gepresenteerd op het 2e Griekse Clinical Nutrition and Metabolism (GrESPEN) congres en op het 13e Nutrition and Dietetics (HDA) congres in Athene, Griekenland (Clinical Nutrition ESPEN Journal 2016; 13:e55). De auteurs willen het bedrijf “ATCARE Ltd” (http://www.atcare.gr) bedanken voor het leveren van de automatische lancetten, glucosemeters en glucosestrips (FORA COMFORT lux GD50) en de supermarktketen “Sklavenitis SA” (Peristeri, Griekenland; http://www.sklavenitis.gr) voor het leveren van een deel van de testmaaltijden, en informatie over de voedingswaarde van deze maaltijden. Dit onderzoek heeft geen specifieke subsidie ontvangen van financiers in de publieke, commerciële of non-profit sector.
Belangenverstrengeling: De auteurs verklaren dat er geen sprake is van belangenverstrengeling met betrekking tot de publicatie van dit artikel.
Vertaling Kirsten Berk en Gerdien Ligthart-Melis
REFERENTIES
ADA and A. D. Association) (2018). “4. Lifestyle management: standards of medical care in diabetes—2018.” Diabetes Care 41(Supplement 1): S38-S50.
ADA and A. D. Association) (2018). “6. Glycemic Targets: Standards of Medical Care in Diabetes.” Diabetes Care 41: S55-S64.
Ahern, J. A., P. M. Gatcomb, N. A. Held, W. A. Petit, Jr. and W. V. Tamborlane (1993). “Exaggerated hyperglycemia after a pizza meal in well-controlled diabetes.” Diabetes Care 16(4): 578-580.
Bao, J., H. R. Gilbertson, R. Gray, D. Munns, G. Howard, P. Petocz, S. Colagiuri and J. C. Brand-Miller (2011). “Improving the estimation of mealtime insulin dose in adults with type 1 diabetes: the Normal Insulin Demand for Dose Adjustment (NIDDA) study.” Diabetes Care 34(10): 2146-2151.
Bell, K. J., A. W. Barclay, P. Petocz, S. Colagiuri and J. C. Brand-Miller (2014). “Efficacy of carbohydrate counting in type 1 diabetes: a systematic review and meta-analysis.” The Lancet Diabetes & Endocrinology 2(2): 133-140.
Bell, K. J., R. Gray, D. Munns, P. Petocz, G. Howard, S. Colagiuri and J. C. Brand-Miller (2014). “Estimating insulin demand for protein-containing foods using the food insulin index.” Eur J Clin Nutr 68(9): 1055-1059.
Bell, K. J., C. E. Smart, G. M. Steil, J. C. Brand-Miller, B. King and H. A. Wolpert (2015). “Impact of fat, protein, and glycemic index on postprandial glucose control in type 1 diabetes: implications for intensive diabetes management in the continuous glucose monitoring era.” Diabetes Care 38(6): 1008-1015.
Bevier, W. C., H. Zisser, C. C. Palerm, D. A. Finan, D. E. Seborg, F. J. Doyle, A. O. Wollitzer and L. Jovanovic (2007). “Calculating the insulin to carbohydrate ratio using the hyperinsulinaemic-euglycaemic clamp-a novel use for a proven technique.” Diabetes Metab Res Rev 23(6): 472-478.
Bozzetto, L., A. Alderisio, M. Giorgini, F. Barone, A. Giacco, G. Riccardi, A. A. Rivellese and G. Annuzzi (2016). “Extra-Virgin Olive Oil Reduces Glycemic Response to a High-Glycemic Index Meal in Patients With Type 1 Diabetes: A Randomized Controlled Trial.” Diabetes Care 39(4): 518-524.
Ceriello, A., K. Esposito, L. Piconi, M. A. Ihnat, J. E. Thorpe, R. Testa, M. Boemi and D. Giugliano (2008). “Oscillating glucose is more deleterious to endothelial function and oxidative stress than mean glucose in normal and type 2 diabetic patients.” Diabetes 57(5): 1349-1354.
De Palma, A., E. Giani, D. Iafusco, A. Bosetti, M. Macedoni, A. Gazzarri, D. Spiri, A. E. Scaramuzza and G. V. Zuccotti (2011). “Lowering postprandial glycemia in children with type 1 diabetes after Italian pizza “margherita” (TyBoDi2 Study).” Diabetes Technol Ther 13(4): 483-487.
Dyson, P., T. Kelly, T. Deakin, A. Duncan, G. Frost, Z. Harrison, D. Khatri, D. Kunka, P. McArdle and D. Mellor (2011). “Diabetes UK evidence‐based nutrition guidelines for the prevention and management of diabetes.” Diabetic Medicine 28(11): 1282-1288.
Fountoulakis, K. N., A. lacovides, S. Samolis, S. Kleanthous, S. G. Kaprinis, G. St Kaprinis and P. Bech (2001). “Reliability, validity and psychometric properties of the Greek translation of the Zung Depression Rating Scale.” BMC Psychiatry 1: 6.
Friedewald, W. T., R. I. Levy and D. S. Fredrickson (1972). “Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge.” Clin Chem 18(6): 499-502.
Fu, S., L. Li, S. Deng, L. Zan and Z. Liu (2016). “Effectiveness of advanced carbohydrate counting in type 1 diabetes mellitus: a systematic review and meta-analysis.” Sci Rep 6: 37067.
Garcia-Lopez, J. M., M. Gonzalez-Rodriguez, M. Pazos-Couselo, F. Gude, A. Prieto-Tenreiro and F. Casanueva (2013). “Should the amounts of fat and protein be taken into consideration to calculate the lunch prandial insulin bolus? Results from a randomized crossover trial.” Diabetes Technol Ther 15(2): 166-171.
Hommel, E., S. Schmidt, D. Vistisen, K. Neergaard, M. Gribhild, T. Almdal and K. Norgaard (2017). “Effects of advanced carbohydrate counting guided by an automated bolus calculator in Type 1 diabetes mellitus (StenoABC): a 12-month, randomized clinical trial.” Diabet Med 34(5): 708-715.
Kavouras, S. A., M. I. Maraki, M. Kollia, A. Gioxari, L. T. Jansen and L. S. Sidossis (2016). “Development, reliability and validity of a physical activity questionnaire for estimating energy expenditure in Greek adults.” Science & Sports 31: e47-e53.
Kawamura, T. (2007). “The importance of carbohydrate counting in the treatment of children with diabetes.” Pediatric Diabetes 8: 57-62.
Klupa, T., T. Benbenek-Klupa, B. Matejko, S. Mrozinska and M. T. Malecki (2015). “The impact of a pure protein load on the glucose levels in type 1 diabetes patients treated with insulin pumps.” Int J Endocrinol 2015: 216918.
Kordonouri, O., R. Hartmann, K. Remus, S. Blasig, E. Sadeghian and T. Danne (2012). “Benefit of supplementary fat plus protein counting as compared with conventional carbohydrate counting for insulin bolus calculation in children with pump therapy.” Pediatr Diabetes 13(7): 540-544.
Lodefalk, M., J. Aman and P. Bang (2008). “Effects of fat supplementation on glycaemic response and gastric emptying in adolescents with Type 1 diabetes.” Diabet Med 25(9): 1030-1035.
Maahs, D. M. and J. Higgins (2012). Is carbohydrate counting enough? Towards perfection or unwanted complexity?, Mary Ann Liebert, Inc. 140 Huguenot Street, 3rd Floor New Rochelle, NY 10801 USA.
MacDonald, K., J. M. Lowe, D. Barker, M. Mensch and J. Attia (2009). “Effect of popular takeaway foods on blood glucose levels in type 1 diabetes mellitus patients on intensive insulin therapy.” Int J Clin Pract 63(2): 189-194.
Meng, H., N. R. Matthan, L. M. Ausman and A. H. Lichtenstein (2017). “Effect of macronutrients and fiber on postprandial glycemic responses and meal glycemic index and glycemic load value determinations.” Am J Clin Nutr 105(4): 842-853.
Monnier, L., C. Colette and D. R. Owens (2009). “Integrating glycaemic variability in the glycaemic disorders of type 2 diabetes: a move towards a unified glucose tetrad concept.” Diabetes/metabolism research and reviews 25(5): 393-402.
Panagiotakos, D. B., C. Pitsavos and C. Stefanadis (2006). “Dietary patterns: a Mediterranean diet score and its relation to clinical and biological markers of cardiovascular disease risk.” Nutr Metab Cardiovasc Dis 16(8): 559-568.
Pankowska, E. and M. Blazik (2010). “Bolus calculator with nutrition database software, a new concept of prandial insulin programming for pump users.” J Diabetes Sci Technol 4(3): 571-576.
Pankowska, E., A. Szypowska, M. Lipka, M. Szpotanska, M. Blazik and L. Groele (2009). “Application of novel dual wave meal bolus and its impact on glycated hemoglobin A1c level in children with type 1 diabetes.” Pediatr Diabetes 10(5): 298-303.
Paterson, M. A., C. E. Smart, P. E. Lopez, P. McElduff, J. Attia, C. Morbey and B. R. King (2016). “Influence of dietary protein on postprandial blood glucose levels in individuals with Type 1 diabetes mellitus using intensive insulin therapy.” Diabet Med 33(5): 592-598.
Paterson, M. A., C. E. M. Smart, P. E. Lopez, P. Howley, P. McElduff, J. Attia, C. Morbey and B. R. King (2017). “Increasing the protein quantity in a meal results in dose-dependent effects on postprandial glucose levels in individuals with Type 1 diabetes mellitus.” Diabet Med 34(6): 851-854.
Peters, A. L. and M. B. Davidson (1993). “Protein and fat effects on glucose responses and insulin requirements in subjects with insulin-dependent diabetes mellitus.” Am J Clin Nutr 58(4): 555-560.
Samakouri, M., G. Bouhos, M. Kadoglou, A. Giantzelidou, K. Tsolaki and M. Livaditis (2012). “[Standardization of the Greek version of Zung’s Self-rating Anxiety Scale (SAS)].” Psychiatriki 23(3): 212-220.
Scavone, G., A. Manto, D. Pitocco, L. Gagliardi, S. Caputo, L. Mancini, F. Zaccardi and G. Ghirlanda (2010). “Effect of carbohydrate counting and medical nutritional therapy on glycaemic control in Type 1 diabetic subjects: a pilot study.” Diabet Med 27(4): 477-479.
Schmidt, S., B. Schelde and K. Nørgaard (2014). “Effects of advanced carbohydrate counting in patients with type 1 diabetes: a systematic review.” Diabetic Medicine 31(8): 886-896.
Smart, C. E., M. Evans, S. M. O’Connell, P. McElduff, P. E. Lopez, T. W. Jones, E. A. Davis and B. R. King (2013). “Both dietary protein and fat increase postprandial glucose excursions in children with type 1 diabetes, and the effect is additive.” Diabetes Care 36(12): 3897-3902.
Souto, D. L., L. Zajdenverg, M. Rodacki and E. L. Rosado (2014). “Impact of advanced and basic carbohydrate counting methods on metabolic control in patients with type 1 diabetes.” Nutrition 30(3): 286-290.
Tascini, G., M. G. Berioli, L. Cerquiglini, E. Santi, G. Mancini, F. Rogari, G. Toni and S. Esposito (2018). “Carbohydrate Counting in Children and Adolescents with Type 1 Diabetes.” Nutrients 10(1).
van der Hoogt, M., J. C. van Dyk, R. C. Dolman and M. Pieters (2017). “Protein and fat meal content increase insulin requirement in children with type 1 diabetes – Role of duration of diabetes.” J Clin Transl Endocrinol 10: 15-21.
Virdi, N. S. and J. J. Mahoney (2012). “Importance of blood glucose meter and carbohydrate estimation accuracy.” J Diabetes Sci Technol 6(4): 921-926.
Winiger, G., U. Keller, R. Laager, J. Girard and W. Berger (1995). “Protein content of the evening meal and nocturnal plasma glucose regulation in type-I diabetic subjects.” Horm Res 44(3): 101-104.
Wolpert, H. A., A. Atakov-Castillo, S. A. Smith and G. M. Steil (2013). “Dietary fat acutely increases glucose concentrations and insulin requirements in patients with type 1 diabetes: implications for carbohydrate-based bolus dose calculation and intensive diabetes management.” Diabetes Care 36(4): 810-816.




